Поступило в редакцию: июль 2014
УДК 547.512; 547.642
Fluorine Notes, 2014, 95, 3-4
Синтез фторсодержащих производных пиразоло[3,4-d]пиримидинонов. Сообщение 1. Синтез фторфенилсодержащих 1-фенил-1Н-пиразоло[3,4-d] [1,3]оксазинонов и фторбензамидов 5-(фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты
М.Е.Жидков, А.В.Куткин, А.Ф.Елеев
Федеральное государственное унитарное предприятие "Государственный научно-исследовательский институт
органической химии и технологии", 111024, Москва, шоссе Энтузиастов, 23
e-mail: dir@gosniiokht.ru
Аннотация. Этиловый эфир 5-амино-1-фенил-1Н-пиразол-4-карбоновой кислоты вовлекали в реакцию с различными хлорангидридами и получали соответствующие этиловые эфиры 5-замещенных фторсодержащих 1-фенил-1Н-пиразол-4-карбоновых кислот, которые в свою очередь были превращены в соответствующие кислоты. Из этих кислот в реакции с уксусным ангидридом были получены новые пиразоло[3,4-d] [1,3]оксазиноны. На их основе синтезированы ранее не известные бензамиды пиразол-4-карбоновой кислоты.
Ключевые слова: Этиловый эфир этоксиметиленциануксусной кислоты, оксазиноны, пиразол, пиримидинон, тонкослойная хроматография, спектры ЯМР 1Н.
Производные пиразоло[3,4-d]пиримидинов общей формулы:
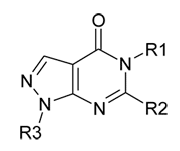
в настоящее время представлены достаточно обширным числом примеров биологически активных веществ, обладающих антимикробным [1,2], антивирусным [3,4], антиаллергическим [5], антигипотензивным [6-8], противоопухолевым [9], противовоспалительным [10] и обезболивающим действием [11]. Общая характеристика биологической активности пиразоло[3,4-d]пиримидинов представлена в обзоре [12].
Описан синтез близких по структуре к описываемым в настоящей статье соединениям [13]. В настоящей работе предложен принципиально новый способ получения, в основу которого положена схема химических превращений, включающая синтез соответствующих пиразоло[3,4-d] [1,3]оксазинонов и на их основе бензамидов пиразол-4-карбоновой кислоты.
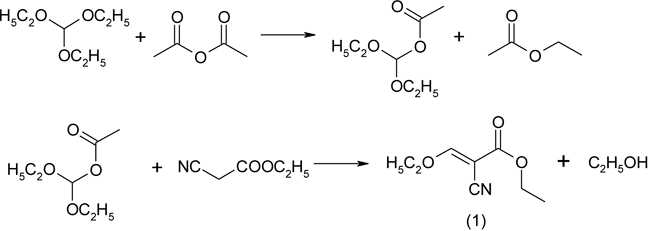
Как известно, введение даже одного атома фтора в молекулу биологически активного вещества может приводить к значительному изменению той или иной биологической активности. С этой целью для последующего изучения биологической активности фторсодержащих аналогов производных пиразоло[3,4-d]пиримидинонов в настоящем исследовании оценивалась возможность синтеза ранее неизвестных аналогов бензамидов пиразол-4-карбоновой кислоты, содержащих атом фтора в качестве заместителя в 2-ом, 3-ем или 4-ом положении бензоильного фрагмента. Синтез целевых соединений включает несколько стадий. На первой стадии осуществлялся синтез этилового эфира этоксиметиленциануксусной кислоты по схеме:
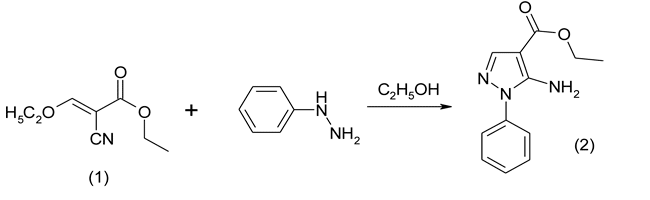
Далее полученный эфир (1) вовлекали в реакцию с фенилгидразином с образованием фенилзамещенного пиразола по схеме:
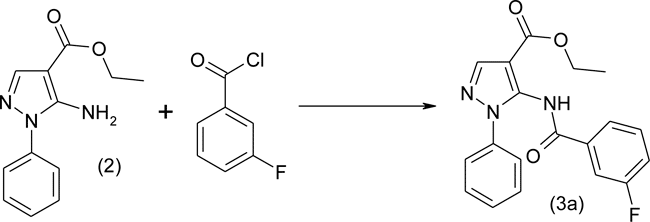
Синтезированный фенилзамещенный пиразол (2) является первым прекурсором в синтезе целевых соединений. В частности, при использовании 3-фторфенилбензоилхлорида был синтезирован, в соответствии с разработанным нами методом ацилирования с среде безводного кипящего 1,4-диоксана без акцептора выделяющегося хлористого водорода, этиловый эфир 5-(3'-фторбензиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3a) по схеме:
По аналогичной схеме с использованием хлорангидридов соответствующих кислот были синтезированы следующие этиловые эфиры: 5-(2'-фторбензоиламино)- (3b), 5-(4'-фторбензоиламино)- (3с), 5-(4'-хлорбензоиламино)- (3d) и 5-(4'-фуроиламино)- (3e) 1-фенил-1Н-пиразол-4-карбоновых кислот. Эти эфиры в реакции с гидроксидом натрия по разработанному нами методу гидролиза водным раствором гидроксида натрия при температуре 50 °С далее были превращены в соответствующие карбоновые кислоты по схеме, показанной на примере получения 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (4a):
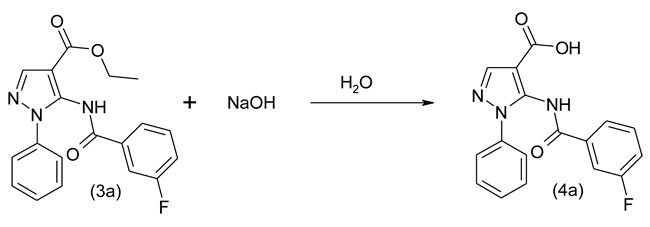
Синтезированные 5-(3'-фторбензоиламино)- (4a), 5-(2'-фторбензиоламино)- (4b), 5-(4'-фторбензоиламино)- (4c), 5-(4'-хлорбензоиламино)- (4d) и 5-(2'-фуроиламино)- (4e) 1-фенил-1Н-пиразол-4-карбоновые кислоты, в свою очередь, в реакции уксусным ангидридом явились основой для получения соответствующих 6-арилзамещенных 1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-онов. Схема приведена для получения 6-(3'-фторфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-она (5a):
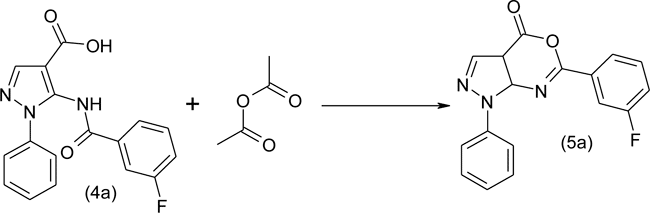
Полученные оксазин-4-оны вовлекались в реакции с различными с ароматическими аминами с образованием соответствующих 5-(фторбензоиламино)замещенных ариламидов 1-фенил-1Н-пиразол-4-карбоновой кислоты. Ниже представлена схема реакции на примере получения 4"-фторфениламида 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты в реакции 6-(3'-фторфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-она с 4-фторанилином:
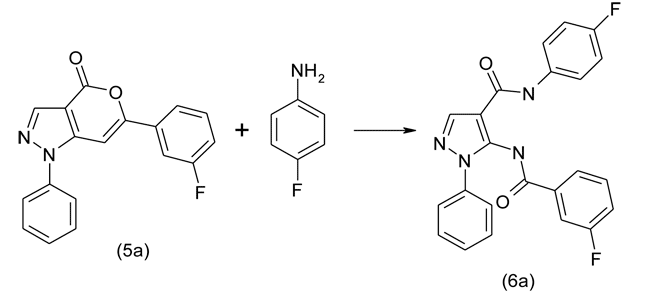
По аналогичным схемам были синтезированы: 1"-нафтиламид 5-(2'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6b), 4"-фторфениламид 5-(4'-хлорбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6c), 2"-(этоксикарбонил)фениламид 5-(4'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6d), 4"-хлорфениламид 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6e), 2",4"-диметоксифениламид 5-(2'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6f).
Экспериментальная часть
Спектры ЯМР 1Н (внешний эталон ТМС) сняты в DMSO-d6 на приборе Bruker AM-400 (400 МГц), температуры плавления веществ определены на приборе Mettler FP5. Контроль за ходом реакции и индивидуальностью полученных веществ осуществлялся методом ТСХ на пластинах Silufol UV 254 в системе толуол-ацетон 4:1.
Этиловый эфир этоксиметиленциануксусной кислоты (1) В трехгорлый реактор на 500 мл, снабженный перемешивающим устройством, термометром, и колонкой с обратным холодильником помещают 111,2 г (124,75 мл; 0,75 моль) триэтилортоформиата, 56,6 г (53,2 мл, 0,5 моль) этилового эфира циануксусной кислоты и 102,1 г (94,5 мл, 1,0 моль) уксусного ангидрида. Реакционную массу нагревают в течение 1 часа при температуре бани 140°С, затем в течение 1 часа при температуре 150°С. При этом отгоняется этиловый эфир уксусной кислоты. Получившийся продукт перегоняют в вакууме. Получают 69,3 г (82,0%) этилового эфира этоксиметиленциануксусной кислоты с т.пл. 50-52 °С и т.кип.173-175 °С при 15 мм.рт.ст. Rf 0,56 (толуол-ацетон 4:1). Спектр ЯМР 1Н (30% в СDCl3), δ м.д.: 1,29 (3Н, т, СН3), 1,42 (3Н, т, СН3), 4,30 (2Н, к, СН2), 4,49 (2Н, к, СН2), 8,03 (1Н, с, СН=). Найдено, %: C 56,21; Н 6,51; N 8,36. С8Н11NO3 Вычислено, %: C 56,80; Н 6,55; N 8,28.
Этиловый эфир 5-амино-1-фенил-1Н-пиразол-4-карбоновой кислоты (2) В 3-хгорлый реактор на 500 мл, снабжённый перемешивающим устройством, термометром и обратным холодильником помещают 69,0 г (0,41 моль) этилового эфира этоксиметиленциануксусной кислоты и 100 мл этилового спирта. Затем к реакционной массе добавляют небольшими порциями раствор 44,3 г (0,41 моль) фенилгидразина в 100 мл этилового спирта. Полученную смесь кипятят при перемешивании в течение часа и отгоняют 150 мл этилового спирта. Затем реакционную массу охлаждают льдом, образовавшиеся кристаллы отфильтровывают, промывают охлаждённым этиловым спиртом, сушат и перекристаллизовывают из 100 мл этилового эфира уксусной кислоты. Получают 65,0 г (68,5%) этилового эфира 5-амино-1-фенил -1Н-пиразол-4-карбоновой кислоты в виде порошка светло-жёлтого цвета с т.пл 100 °С. Rf 0,65 (толуол-ацетон 4:1). Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,39 (3Н, т, СН3); 4,25 (2Н, к, СН2); 5,39 (1Н, с, NH); 7,39 (1Н, м, С6Н5); 7,50 (4Н, м, С6Н5); 7,74 (1Н, с, СН=). Найдено, %: C 61,97; Н 5,73; N 18,21. С12H13N3O2 Вычислено, %: C 62,33; Н 5,67; N 18,17.
Этиловый эфир 5-(3-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3a) В трехгорлый реактор на 100 мл, снабженный перемешивающим устройством, термометром и обратным холодильником с хлоркальциевой трубкой помещают 23,1 г (0,1 моль) этилового эфира 5-амино-1-фенил -1Н-пиразол-4-карбоновой кислоты, 17,4 г (0,11 моль, 13,1 мл) 3-фторбензоилхлорида и 50 мл абсолютного 1,4-диоксана. Реакционную массу кипятят при перемешивании в течение 10 часов и охлаждают. Выпавшие кристаллы отфильтровывают, промывают охлажденным этиловым спиртом и сушат в вакууме при 15 мм. рт. ст. Получают 29,0 г (82%) этилового эфира 5-(2-фторбензиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты в виде порошка белого цвета с т.пл.112-114 °С. Rf 0,45 (толуол-ацетон 4:1). Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,30 (3Н, т, СН3); 4,24 (2Н, к, СН2); 7,15 (2Н, м, С6Н4F); 7,29 (1Н, м, С6Н5); 7,54 (1Н, т, С6Н4F ); 7,81 (1Н, с, СН=); 8,14 (2H, м, С6Н4F); 11,17 (1Н, с, NH). Найдено, %: C 64,76; Н 4,39; N 11,83; F 5,41. С19H16FN3O3 Вычислено, %: C 64,58; Н 4,56; N 11,89; F 5,38.
Аналогичным методом с использованием соответствующих ацилирующих агентов были синтезированы следующие соединения:
- этиловый эфир 5-(2-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3b) с выходом 75,0% в виде порошка белого цвета с т.пл.102-105 °С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,30 (3Н, т, СН3); 4,24 (2Н, к, СН2); 7,15 (1Н, т, С6Н4F); 7,29 (1Н, м, С6Н5); 7,54 (6Н, м, С6Н5 ); 7,81 (1Н, с, СН=); 8,14 (2H, м, С6Н4F); 11,17 (1Н, с, NH). Найдено, %: C 64,51; Н 4,51; N 11,83; F 5,33. С19H16FN3O3 Вычислено, %: C 64,58; Н 4,56; N 11,89; F 5,38.
- этиловый эфир 5-(4-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3c) с выходом 83,0% в виде порошка белого цвета с т.пл.127-130 °С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,30 (3Н, т, СН3); 4,24 (2Н, к, СН2); 7,37 (2Н, т, С6Н4F); 7,54 (5Н, с, С6Н5 ); 7,81 (1Н, с, СН=); 8,16 (2H, т, С6Н4F); 11,17 (1Н, с, NH). Найдено, %: C 64,71; Н 4,58; N 11,92; F 5,42. С19H16FN3O3 Вычислено, %: C 64,58; Н 4,56; N 11,89; F 5,38.
- этиловый эфир 5-(4-хлорбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3d) с выходом 87,0% в виде порошка белого цвета с т.пл.119-124 °С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,30 (3Н, т, СН3); 4,24 (2Н, к, СН2); 7,54 (7Н, м, С6Н5 ); 7,81 (1Н, с, СН=); 7,90 (2H, д, С6Н4Cl); 11,17 (1Н, с, NH). Найдено, %: C 61,82; Н 4,39; N 11,41; Cl 9,63. С19H16ClN3O3 Вычислено, %: C 61,71; Н 4,36; N 11,36; Cl 9,59.
- этиловый эфир 5-(2-фуроиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (3e) с выходом 72,0% в виде порошка белого цвета с т.пл.97-100 °С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 1,30 (3Н, т, СН3); 4,24 (2Н, к, СН2); 6,71 (1Н, т, C4H3O); 7,34 (1Н, д, C4H3O); 7,54 (5H, д, С6Н5); 7,81 (1Н, с, СН=); 7,95 (1H, д, C4H3O), 11,17 (1Н, с, NH). Найдено, %: C 62,81; Н 4,58; N 12,89. С17H15N3O4 Вычислено, %: C 62,76; Н 4,65; N 12,92.
5-(3'-Фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновая кислота (4a) В 2-х горлый реактор на 100 мл, снабжённый перемешивающим устройством, термометром и обратным холодильником помещают 29,0 г (0,082 моль) этилового эфира 5-(3'-фторбензиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты и раствор 6,6 г (0,164 моль) натрия гидроксида в 50 мл воды. Реакционную массу нагревают при энергичном перемешивании до 50 °С и выдерживают при этой температуре в течение 5 часов. Затем реакционную массу отфильтровывают, осветленный маточный раствор подкисляют до рН 2-3 10%-ным раствором хлористоводородной кислоты и отфильтровывают выпавший осадок. Осадок тщательно промывают водой и сушат сначала в сушильном шкафу при температуре 50 °С, а затем в вакууме. Получают 20,3 г (76,3%) 5-(3'-фторбензиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты в виде порошка белого цвета с т.пл.196-199°С. Rf 0,1 (толуол-ацетон 4:1). Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,15 (2Н, м, С6Н4F); 7,29 (1Н, м, С6Н5); 7,54 (4Н, м, С6Н5 ); 7,81 (1Н, с, СН=); 8,14 (2H, м, С6Н4F); 11,17 (1Н, с, NH); 11,95 (1Н, с, COOH). Найдено, %: C 62,81; Н 3,69; N 12,91; F 5,78. С17H12FN3O3 Вычислено, %: C 62,77; Н 3,72; N 12,92; F 5,84.
Аналогичным методом были синтезированы следующие соединения:
- 5-(2-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновая кислота (4b) с выходом 71,8% в виде порошка белого цвета с т.пл.181-183°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,15 (1Н, т, С6Н4F); 7,29 (1Н, т, С6Н5); 7,54 (7Н, м, С6Н5 ); 7,81 (1Н, с, СН=); 8,14 (1H, м, С6Н4F); 11,17 (1Н, с, NH); 11,95 (1Н, с, COOH). Найдено, %: C 62,83; Н 3,72; N 12,94; F 5,81. С17H12FN3O3 Вычислено, %: C 62,77; Н 3,72; N 12,92; F 5,84.
- 5-(4-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновая кислота (4c) с выходом 78,3% в виде порошка белого цвета с т.пл.210-213°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,37 (2Н, т, С6Н4F); 7,54 (5Н, м, С6Н5 ); 7,81 (1Н, с, СН=); 8,16 (2H, м, С6Н4F); 11,15 (1Н, с, NH); 11,77 (1Н, с, COOH). Найдено, %: C 62,79; Н 3,74; N 12,88; F 5,85. С17H12FN3O3 Вычислено, %: C 62,77; Н 3,72; N 12,92; F 5,84.
- 5-(4-хлорбензоиламино)-1-фенил-1Н-пиразол-4-карбоновая кислота (4d) с выходом 73,3% в виде порошка белого цвета с т.пл.223-225°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,55 (7Н, м, С6Н5 ); 7,87 (1Н, с, СН=); 7,90 (2H, д, С6Н4Cl); 11,23 (1Н, с, NH); 11,85 (1Н, с, COOH). Найдено, %: C 59,75; Н 3,49; N 12,31; Cl 10,35. С17H12ClN3O3 Вычислено, %: C 59,79; Н 3,54; N 12,30; Cl 10,37.
- 5-(2-фуроиламино)-1-фенил-1Н-пиразол-4-карбоновая кислота (4e)
с выходом 69,2 % в виде порошка белого цвета с т.пл.187-190 °С. Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д.: 6,71 (1Н, т, C4H3O); 7,34 (1Н, д, C4H3O ) 7,54 (5Н, с, С6Н5); 7,85 (1Н, с, СН=); 7,95 (1H, д, C4H3O); 11,10 (1Н, с, NH); 11,27 (1Н, с, COOH). Найдено, %: C 60,59; Н 3,75; N 14,12. С15H11N3O4 Вычислено, %: C 60,61; Н 3,73; N 14,14.
6-(3'-Фторфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-он (5a)
В двухгорлый реактор на 100 мл, снабжённый перемешивающим устройством, термометром и обратным холодильником помещают 20,3 г (0,063 моль) 5-(3'-фторбензиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты и 50 мл ангидрида уксусной кислоты. Реакционную массу кипятят при энергичном перемешивании в течение 2 часов и охлаждают до комнатной температуры. Выпавшие кристаллы отфильтровывают, промывают охлажденным этиловым спиртом и сушат в вакууме. Получают 16,9 г (86,8 %) 6-(3'-фторофенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-она в виде кристаллов белого цвета с т.пл.173-176 °С. Rf 0,85 (толуол-ацетон 4:1). Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,27 (1Н, т, С6Н4F); 7,36 (1Н, т, С6Н4F); 7,54 (5Н, м, С6Н5 ); 7,79 (1Н, м, С6Н4F); 8,04 (1H, д, С6Н4F); 8,15 (1Н, с, СН=). Найдено, %: C 66,39; Н 3,32; N 13,65; F 6,21. С17H10FN3O2 Вычислено, %: C 66,45; Н 3,28; N 13,67; F 6,18.
Аналогичным методом были синтезированы следующие соединения:
-6-(2'-Фторфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-он. (5b)
с выходом 67,0% в виде порошка белого цвета с т.пл.201-204°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,27 (1Н, т, С6Н4F); 7,36 (1Н, т, С6Н4F ); 7,55 (5Н, м, С6Н5); 7,79 (1Н, м, С6Н4F ); 8,04 (2H, д, С6Н5); 8,15 (1Н, с, СН=). Найдено, %: C 66,44; Н 3,29; N 13,59; F 6,20. С17H10FN3O2 Вычислено, %: C 66,45; Н 3,28; N 13,67; F 6,18.
-6-(4'-Фторфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-он. (5c)
с выходом 73,9% в виде порошка белого цвета с т.пл.220-225°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,36 (2Н, т, С6Н4F); 7,55 (3Н, м, С6Н5 ); 7,79 (2Н, т, С6Н4F); 8,04 (2Н, д, С6Н5); 8,17 (1Н, с, СН=). Найдено, %: C 66,44; Н 3,29; N 13,59; F 6,18. С17H10FN3O2 Вычислено, %: C 66,45; Н 3,28; N 13,67; F 6,18.
-6-(4'-Хлорфенил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-он (5d)
с выходом 79,4% в виде порошка белого цвета с т.пл.231-233°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д.: 7,55 (5Н, м, С6Н5); 7,75 (2Н, д, С6Н4Cl ); 8,04 (2Н, д, С6Н5); 8,10 (1Н, с, СН=). Найдено, %: C 63,11; Н 3,14; N 12,99; Cl 10,89. С17H10ClN3O2 Вычислено, %: C 63,07; Н 3,11; N 12,98; Cl 10,95.
- 6-(2'-Фуроил)-1-фенил-1Н-пиразоло[3,4-d][1,3]оксазин-4-он (5e)
с выходом 73,9 % в виде порошка белого цвета с т.пл.211-213 °С. Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д.: 6,74 (1Н, т, C4H3O); 7,14 (1Н, д, C4H3O); 7,55 (3Н, м, С6Н5); 7,97 (1Н, д, C4H3O); 8,07 (2Н, д, С6Н5); 8,16 (1Н, с, СН=). Найдено, %: C 64,49; Н 3,32; N 15,17. С15H10N3O3 Вычислено, %: C 64,52; Н 3,25; N 15,05.
(4"-Фторфенил)амид 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол -4-карбоновой кислоты (6a). В 2-хгорлый реактор, снабжённый термометром и обратным холодильником, помещают 1,0 г (3 ммоль) 6-(3'-фторофенил)-1-фенил-1Н-пиразоло-[3,4-d][1,3]оксазин-4-она и 0,40 г (0,34 мл, 3,6 ммоль) свежеперегнанного 4-фторанилина. Реакционную массу нагревают до температуры 100 – 120 °С в течение 1 часа. Затем реакционную массу охлаждают, добавляют 10 мл этилового спирта и кипятят в течение 5 минут. Получившийся гомогенный раствор охлаждают на ледяной бане, при этом выпадает осадок. Осадок отфильтровывают на фильтре Шотта, промывают этиловым спиртом и сушат сначала на фильтре, а затем в вакууме. Получают 1,15 г (91,3 %) (4"-фторфенил) амида 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты в виде порошка серого цвета с т.пл. 210-215 °С. Rf 0,25 (толуол-ацетон 4:1). Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д.: 7,17 (1Н, т, С6Н5); 7,45 (3Н, м, С6Н5); 7,58 (3Н, м, С6Н5 ); 7,68 (3Н, м, С6Н5); 7,70 (1H, д, С6Н5); 8,42 (1Н, с, -СН=); 10,06 (1Н, с, NH); 10,58 (1Н, с, NH). Найдено, %: C 64,49; Н 3,32; N 15,17; F 9,05. С23H16F2N4O2 Вычислено, %: C 64,52; Н 3,25; N 15,05; F 9,08.
Аналогичным методом были синтезированы следующие соединения:
- (1"-Нафтил)амид 5-(2'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6b) с выходом 87,2 % в виде порошка сероватого цвета с т.пл.215-220 °С. Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д: 7,30 (2Н,м,С6Н5), 7,48 (1Н, м, С6Н5), 7,55 (6Н, м, С6Н5), 7,65 (4Н, м, С6Н5), 7,87 (1Н, д, С6Н5), 7,98 (1Н, д, С6Н5), 8,03 (1Н, д, С6Н5), 8,55 (1Н, с, -СН=), 10,10 (1Н,с, NH), 10,50 (1H, с, NH). Найдено, %: C 71,97; Н 4,29; N 12,39. С27H19N4O2 Вычислено, %: C 71,99; Н 4,25; N 12,44.
- (4"-Фторфенил)амид 5-(4'-хлорбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6c) с выходом 91,1% в виде порошка желтоватого цвета с т.пл.210-213 °С. Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д: 7,17 (1Н,т, С6Н5), 7,45 (3Н, м, С6Н5), 7,58 (3Н, м, С6Н5), 7,68 (3Н, м, С6Н5), 7,70 (1Н, д, С6Н5), 8,42 (1Н, с, -СН=), 10,06 (1Н,с, NH), 10,60 (1H, с, NH). Найдено, %: C 63,52; Н 3,69; N 12,91; F 4,35; Cl 8,17. С23H16FClN4O2 Вычислено, %: C 63,53; Н 3,71; N 12,88; F 4,37; Cl 8,15.
- (2"-Этоксикарбонилфенил)амид 5-(4'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6d) ) с выходом 73,9% в виде порошка белого цвета с т.пл.180-183°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д: 1,20 (3Н, т, СН3), 4,08 (2Н, к, СН2), 7,20 (1Н, т, С6Н5), 7,36 (3Н, м, С6Н5), 7,50 (2Н, т, С6Н5), 7,58 (3Н, м, С6Н5), 7,96 (3Н, м, С6Н5), 8,28 (1Н, с, -СН=), 8,55 (1Н, д, С6Н5), 10,70 (1Н, с, NH), 11,29 (1Н, с, NH). Найдено, %: C 66,13; Н 4,45; N 11,89; F 4,01. С26H21FN4O4 Вычислено, %: C 66,10; Н 4,48; N 11,86; F 4,02.
- (4"-Хлорфенил)амид 5-(3'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6e) с выходом 92,1% в виде порошка серого цвета с т.пл.208-210°С. Спектр ЯМР 1Н (20% в СDCl3), δ, м.д: 7,50 (9Н, м, С6Н5), 7,57 (4Н, м, С6Н5), 8,43 (1Н, с, -СН=), 10,15 (1Н, с, NH), 10,65 (1Н, с, NH). Найдено, %: C 63,49; Н 3,71; N 12,92; F 4,36; Cl 8,13. С23H16FClN4O2 Вычислено, %: C 63,53; Н 3,71; N 12,88; F 4,37; Cl 8,15.
- (2", 4"-Диметоксифенил)амид 5-(2'-фторбензоиламино)-1-фенил-1Н-пиразол-4-карбоновой кислоты (6f) с выходом 77,5% в виде порошка темно-серого цвета с т.пл.180-183 °С. Спектр ЯМР 1Н (20 % в СDCl3), δ, м.д: 3,55 (3Н, с, ОСН3), 3,85 (3Н, с, ОСН3), 6,52 (1Н, д, С6Н5), 6,60 (1Н, с, С6Н5), 7,35 (1Н, м, С6Н5), 7,45 (1Н, м, С6Н5), 7,60 (6Н, м, С6Н5), 7,78 (1Н, д, С6Н5), 8,33 (1Н, с, -СН=), 8,95 (1Н, с, NH), 10,60 (1Н, с, NH). Найдено, %: C 65,23; Н 4,61; N 12,15; F 4,10. С25H21FN4O4 Вычислено, %: C 65,21; Н 4,60; N 12,17; F 4,13.
Список литературы
- S. V. Nielsen, E. B. Pedersen, Chem. Scr, 23, 1984, p. 240-244.
- M. M. Ghorab, Acta Pharmaceutica (Zagreb), 50, 2000, p. 93-110.
- E. R. Bendary, F. A. Badria, Arch. Pharm., 333, p. 99-103.
- C. Jyh-Haur, S. Kak-Shan, H. Tsu-An, T. Chia-Liang, et al., Bioorg. Med. Chem. Lett., 14, 2004, p. 2519-2531.
- P. P. Gupta, R. C. Srimal, K. Avasthi, T. Chandra, D. S. Bhakuni, Indian J. Exp. Biol., 33, 1995, p. 38-40.
- S. A. El-Feky, Z. K. Abd el-Samii, Pharmazie, 51, 1996, p. 540-543.
- G. Szilagyi, E. Kasztreiner, L. Tardos, E. Kosa, L. Jaszlits, G. Cseh, et al., Ger. Offen. 2,825, 906 (Cl. CO 7D 403/04), (1979), Hung. Appl. 1, 373, 1977; Chem. Abstr., 90, 152224x (1979).
- B. Dumaitre, N. Dodic, J. Med. Chem., 39,1996, р. 1635 – 1644.
- M. M. Ghorab, F. A. Ragab, E. Noaman, H. I. Heiba, S. A. Aboulmagd, Arzneimittelforschung, 59 (2), 2009, р. 96–103.
- I. Devesa, M. J. Alcaraz, A. Riguera, M. L. Ferrandis, Eur. J. Pharm., 488, 2004, p. 225-230.
- J. W. Marsico, J. P. Joseph, US: 3864,359 (Cl. 260–310R; CO 7d), 4 February 1975, Appl. 248, 990, 1 May 1972; 6 pp; Chem. Abstr., 82, 170936v (1975).
- M. Chauhan, R. Kumar, Bioor.& Med.Chem., 21, 2013, p. 5657-5668.
- K. Yang, X. He, H. Choi, Z. Wang, D. H. Woodmansee, H. Liu, Tetr.Lett., 49, 2008, p.1725-1728.
Статья рекомендована к публикации членом редколлегии проф. Елеевым А.Ф.
Fluorine Notes, 2014, 95, 3-4


