Поступило в редакцию: май 2014
УДК 547.835.5:579.61
Fluorine Notes, 2014, 94, 3-4
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ СЕРИИ ПРОИЗВОДНЫХ ФТОРЗАМЕЩЕННЫХ АКРИДОНУКСУСНЫХ КИСЛОТ
Т.Н. Кудрявцева,1 К.В. Богатырев,1 Л.Г. Климова 2, Е.А. Батуев 3
1 Курский государственный университет, 305000 г. Курск, ул. Радищева, 33
e-mail:
labOS.kgu@mail.ru
2 Курский государственный медицинский университет, 305041 г. Курск, ул. Карла Маркса, 3
3 Институт молекулярной биологии им. В.А. Энгельгардта, 119991 г. Москва, ул. Вавилова, 32
Аннотация. Получены новые производные различных фторакридонуксусных кислот, исследована их противомикробная активность в отношении группы тест-штаммов микроорганизмов, обнаружено влияние структуры полученных соединений на их антибактериальную активность.
Ключевые слова: Фторзамещенные акридонуксусные кислоты, сложные эфиры, амиды, противомикробное действие
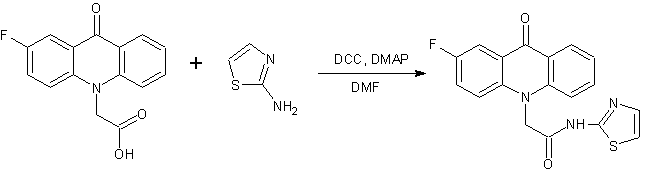
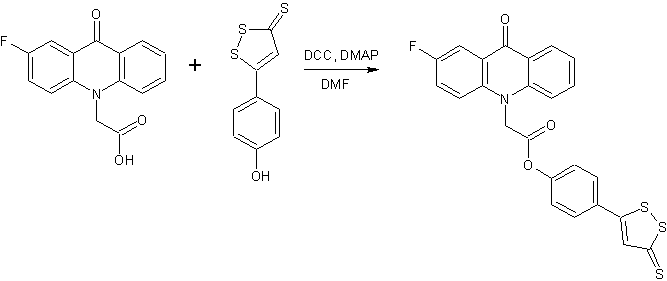
Продолжая поиск биологически-активных веществ в ряду производных фторзамещенных акридонуксуных кислот (АУК) [1], нами была поставлена задача синтезировать серию новых продуктов, содержащих соединенный с конденсированной системой акридона посредством амидной или сложноэфирной связи дополнительный фармакофорный гетероциклический фрагмент. В качестве таких фармакофоров были выбраны 2-аминотиазол, 2-(2-метил-5-нитро-1H-имидазол-1-ил)этанол, 2-(гидроксиметил)фуран, тетрагидро-2-фуранметанол, 4-метил-5-(2-гидроксиэтил)тиазол и 5-(4-гидроксифенил)-3H-1,2-дитиол-3-тион.
Выбор гетероциклических фармакофорных групп обусловлен следующими причинами: некоторые производные 2-аминотиазола обладают противомикробным действием [2,3], фрагмент 2-аминотиазола присутствует в структуре таких известных антибактериальных препаратов, как сульфатиазол, нитазол, карумонам, азтреонам, тенонитрозол, цефтриаксон [4].
Широко применяется в медицинской практике препарат метронидазол (2-(2-метил-5-нитро-1H-имидазол-1-ил)этанол), обладающий антипротозойным и противомикробным действием. Это соединение вызывает повреждения молекул ДНК за счет образования комплексов или разрывов цепи и эффективно в отношении Trichomonas vaginalis, Entamoeba histolytica, а также облигатных анаэробов, которые преобразуют метронидазол в реакционноспособный гидроксиламинный метаболит, что и приводит к необратимым изменениям структуры ДНК [5,6].
Производные 4-метил-5-(2-гидроксиэтил)тиазола, который можно рассматривать как часть молекулы тиамина (витамина В1), обладают рядом полезных фармакологических свойств. Так, препарат клометиазол (5-(2-хлорэтил)-4-метилтиазола этандисульфонат) оказывает седативное, снотворное и противосудорожное действие, а фторсодержащие аналоги 4-метил-5-(2-гидроксиэтил)тиазола проявляют бактериостатическую активность [7,8].
В настоящее время активно изучаются производные 5-(4-гидроксифенил)-3H-1,2-дитиол-3-тиона (ADT-OH), который является широко используемым для синтеза фармакологических гибридов соединением-донором H2S в живых организмах. Было установлено, что 4-(3H-1,2-дитиол-3-тион-5-ил)фениловые эфиры различных карбоновых кислот проявляют противовоспалительное и противоопухолевое действие [9-11].
Фрагменты 2-(гидроксиметил)фурана и тетрагидро-2-фуранметанола также содержатся во многих биологически-активных веществах [12,13].
Одним из универсальных методов получения сложных эфиров и амидов является карбодиимидная активация карбоновых кислот. Для этих целей применяются различные карбодиимиды, из которых наиболее простой и дешевый N,N-дициклогексилкарбодиимид (DCC). Указанный метод синтеза и был использован для получения целевых соединений.
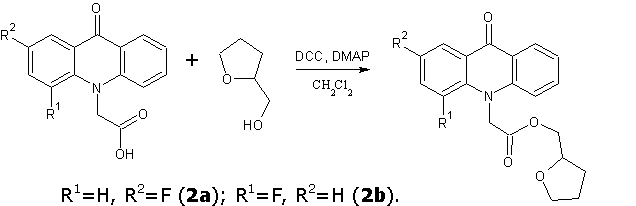
Тетрагидрофуран- и фуран-2-илметиловые эфиры различных фторакридонуксусных кислот получали в среде дихлорметана в присутствии DCC и каталитических количеств N,N-диметиламинопиридина (DMAP) при комнатной температуре в течение 6 часов. Выпавший осадок N,N-дициклогексилмочевины отфильтровывали, растворитель упаривали, и полученные технические продукты очищали методом колоночной хроматографии (силикагель-60 Merck, элюент толуол: ацетон: этанол в объемных соотношениях 10:3:2).
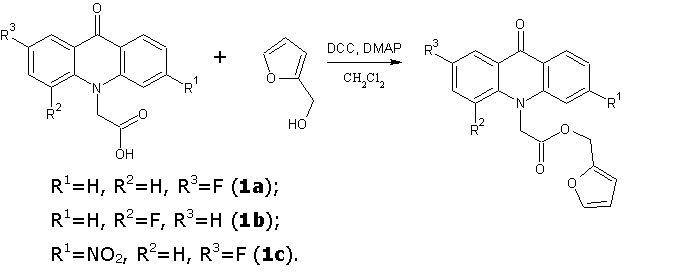
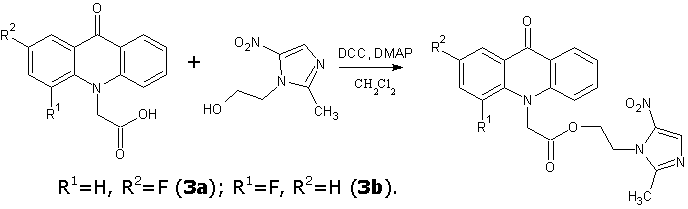
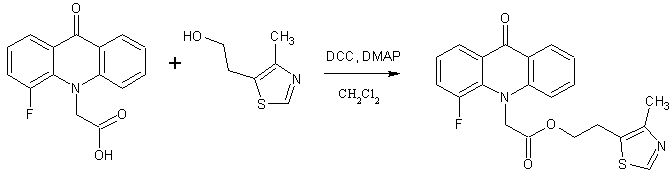
Аналогичным образом синтезировали 2-(4-метил-1,3-тиазол-5-ил)этиловые и 2-(2-метил-5-нитро-1H-имидазол-1-ил)этиловые эфиры 2- и 4-фторакридонуксусных кислот.
Следует отметить, что одним из возможных способов синтеза фуран-2-илметиловых и 2-(4-метил-1,3-тиазол-5-ил)этиловых эфиров является переэтерификация метиловых, этиловых или бутиловых эфиров соответствующих АУК спиртом с пятичленным гетероциклическим фрагментом в присутствии каталитических количеств NaOCH3. Однако мы установили, что аналогичная реакция для тетрагидро-2-фуранметанола приводит к крайне низкому выходу эфира.
Синтез производных 2-аминотиазола и ADT-OH протекал в течение более продолжительного времени (8-10 часов). Конечные продукты обладают плохой растворимостью в дихлорметане, поэтому реакции проводили в среде ДМФА. Полученные технические продукты промывали горячим раствором CHCl3 для удаления примесей исходных веществ, N,N-дициклогексилмочевины и N,N-дициклогексилкар-бамимидатов фторакридонуксусных кислот.
В ЯМР 1Н спектрах полученных соединений присутствуют сигналы протонов, соответствующие акридоновой трициклической системе, а также сигналы, относящиеся к присоединенным фармакофорным гетероциклическим фрагментам.
В предыдущей работе [1] нами была выявлена противомикробная активность ряда производных 2-фторакридонуксусной кислоты, поэтому было интересно оценить антибактериальное действие соединений с атомом фтора в положении 4 акридонового кольца. На серии тест-штаммов микроорганизмов была исследована антибактериальная активность соединений 2b, 3b и 4 (1% и 2% растворы в ДМСО), результаты приведены в таблице 1.
Таблица 1. Противомикробная активность соединений 2b, 3b, 4.
|
Вещество |
С, % |
Е. coli (АТСС 25922) |
Ps. aeruginosa (АТСС 27853) |
Pr.vulgaris (АТСС 4636) |
S. aureus (АТСС 25923) |
B.subtilis (АТСС 6633) |
Candida albicans (NCTC2625) |
|
Зона задержки роста, мм |
|||||||
|
3b |
1 |
10.50±0.40 |
8.50±0.73 |
10.50±0.61 |
8.00±0.45 |
20.50±0.92 |
11.00±0.54 |
|
2 |
9.00±0.79 |
7.00±0.56 |
10.50±0.67 |
8.00±0.70 |
22.50±0.85 |
11.00±0.69 |
|
|
Метро-нидазол |
1 |
11.50±0.39 |
20.00±0.74 |
14.00±0.42 |
22.00±0.70 |
14.50±0.37 |
20.00±0.63 |
|
2 |
12.00±0.35 |
21.00±0.61 |
22.00±0.73 |
25.00±0.68 |
15.00±0.40 |
25.00±0.75 |
|
|
2b |
1 |
10.50±0.54 |
10.50±0.66 |
10.00±0.60 |
9.00±0.58 |
7.00±0.38 |
12.00±0.75 |
|
2 |
11.50±0.71 |
11.50±0.80 |
9.00±0.47 |
9.00±0.77 |
7.00±0.42 |
11.00±0.59 |
|
|
4 |
1 |
10.50±0.84 |
8.00±0.59 |
7.50±0.63 |
8.00±0.38 |
8.00±0.40 |
10.50±0.70 |
|
2 |
12.50±0.62 |
8.50±0.50 |
8.00±0.45 |
8.50±0.56 |
9.50±0.81 |
12.00±0.68 |
|
|
Риванол |
1 |
12.75±0.47 |
12.00±1.14 |
12.50±0.83 |
17.00±1.02 |
14.05±0.94 |
13.50±0.56 |
|
2 |
14.50±0.57 |
15.00±0.93 |
15.00±0.66 |
20.00±0.97 |
15.00±1.14 |
15.00±0.96 |
|
Наибольший интерес представляло определение антибактериального действия 2-(2-метил-5-нитро-1H-имидазол-1-ил)этилового эфира 4-фторакридонуксусной кислоты, так как ранее было установлено, что аналогичный эфир незамещенной АУК по ряду показателей ингибирует рост микроорганизмов эффективнее, чем исходный препарат метронидазол [14]. Однако полученный продукт 3b в целом показал активность ниже, чем 2-(2-метил-5-нитро-1H-имидазол-1-ил)этиловый эфир АУК, но по значениям зон задержки роста B.subtilis превзошел метронидазол. Введение фтора в 4 положение акридонового кольца сопровождается снижением антибактериального действия и в случае соединений 2b и 4. В таблице 2 приведена сравнительная активность 2-(4-метил-1,3-тиазол-5-ил)этиловых эфиров незамещенной, 2- и 4-фтор АУК.
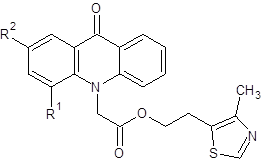
Таблица 2. Сравнительная антибактериальная активность 2-(4-метил-1,3-тиазол-5-ил)этиловых эфиров различных акридонуксусных кислот.
|
Веще- ство |
С, % |
Е. coli (АТСС 25922) |
Ps. aeruginosa (АТСС 27853) |
Pr.vulgaris (АТСС 4636) |
S. aureus (АТСС 25923) |
B.subtilis (АТСС 6633) |
Candida albicans (NCTC2625) |
|
Зона задержки роста, мм |
|||||||
|
R1=H, R2=H |
1 |
9.00±0.34 |
12.25±1.04 |
9.00±0.36 |
9.00±0.46 |
10.00±0.33 |
12.50±0.47 |
|
2 |
9.00±0.51 |
13.50±0.56 |
10.00±0.39 |
9.25±0.52 |
10.50±0.72 |
14.00±0.32 |
|
|
R1=H, R2=F |
1 |
8.80±0.71 |
10.05±0.94 |
11.50±0.32 |
14.00±0.75 |
10.00±0.37 |
13.50±0.94 |
|
2 |
9.00±0.75 |
13.50±0.66 |
15.00±1.09 |
14.50±0.97 |
11.50±0.32 |
15.00±1.09 |
|
|
R1=F, R2=H |
1 |
10.50±0.84 |
8.00±0.59 |
7.50±0.63 |
8.00±0.38 |
8.00±0.40 |
10.50±0.70 |
|
2 |
12.50±0.62 |
8.50±0.50 |
8.00±0.45 |
8.50±0.56 |
9.50±0.81 |
12.00±0.68 |
|
Следует отметить, что 2-(4-метил-1,3-тиазол-5-ил)этиловый эфир 2-фтор АУК обладает несколько более высоким противомикробным действием, чем незамещенный аналог, в то время как у производного 4-фтор АУК в целом наблюдается уменьшение антибактериальной активности.
Соединения 2b и 4 по некоторым показателям активности сопоставимы с препаратом сравнения риванолом (наиболее близкое по структуре антибактериальное лекарственное средство – 2-этокси-6,9-диаминоакридина лактат).
Экспериментальная часть
ТСХ выполняли на пластинах «Sorbfil» ПТСХ-П-В-УФ, элюент – толуол: ацетон: этанол в объемных соотношениях 10:3:2. ИК-спектры получали с помощью спектрометра ФСМ 1201 Мониторинг, таблетки в KBr. Масс-спектры регистрировали системой ACQUITY UPLC H-Class с УФ/масс-детекторами ACQUITY SQD Waters. ЯМР 1Н спектры регистрировали на спектрометре Bruker AV-600, растворитель ДМСО-d6.
Синтез различных фторакридонуксусных кислот и определение противомикробной активности осуществляли по методикам, описанным ранее [1]. Используемые в работе гетероциклические амины и спирты – коммерчески доступные реагенты.
Общая методика
синтеза соединений 1-4
Смесь 3 ммоль соответствующей фторакридонуксусной кислоты, 3 ммоль спирта, содержащего пятичленный гетероциклический фрагмент, 0.61 г (3 ммоль) N,N-дициклогексилкарбодиимида, 0.04 г (0.33 ммоль) N,N-диметиламинопиридина и 30 мл CH2Cl2 перемешивают при комнатной температуре в течение 5-6 часов. Выпавший осадок N,N′-дициклогексилмочевины отфильтровывают, растворитель упаривают. Полученное техническое вещество очищают методом колоночной хроматографии на силикагеле-60 Merck, элюент – толуол: ацетон: этанол в объемных соотношениях 10:3:2.
Общая методика синтеза соединений 5,6
Смесь 3 ммоль соответствующей фторакридонуксусной кислоты, 3 ммоль 2-аминотиазола или ADT-OH, 0.61 г (3 ммоль) N,N-дициклогексилкарбодиимида, 0.04 г (0.33 ммоль) N,N-диметиламинопиридина и 25 мл ДМФА перемешивают при комнатной температуре в течение 8-10 часов. Осадок N,N′-дициклогексилмочевины отфильтровывают, фильтрат выливают в 50 мл воды. Выпавший осадок отфильтровывают и промывают горячим раствором CHCl3 (3х20 мл).
Фуран-2-илметил(2-фтор-9-оксоакридин-10(9H)-ил)ацетат (1a)
Кристаллическое вещество темно-желтого цвета. Выход: 83 %, т.пл. 179-180 °С. Rf = 0.81. Масс-спектр, m/z (Iотн (%)):352 [М+H]+ (100), 272 [C15H10FNO3 + H]+ (20), 226 [C14H10FNO – H]+ (84). ИК-спектр (KBr) ν, см-1: 3120–2856 (С—Н); 1744 (С=Оэфирн.); 1623 (С=Оакридона); 1603, 1493, 1470 (С-Сар). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 5.22 (с, 2 Н, C(2a)H2); 5.52 (с, 2 Н, C(1a)H2); 6.49 (т, 1 H, C(2b)H, J = 3.1, J =1.8); 6.56 (д, 1 H, C(1b)H, J = 3.1); 7.38 (т, 1 H, C(7)H, J = 7.4); 7.64 (д, 1 H, C(4)H, J = 8.8); 7.71 – 7.77 (м, 3 Н, C(3)H, C(5)H, C(3b)H); 7.81(т, 1 H, C(6)H, J = 7.9); 7.99 (дд, 1 H, C(1)H, J = 8.7, J = 2.8); 8.34 (д, 1 H, C(8)H, J = 7.9).
Фуран-2-илметил(4-фтор-9-оксоакридин-10(9H)-ил)ацетат (1b)
Кристаллическое вещество коричневого цвета. Выход: 85 %, т.пл. 151-152 °С. Rf = 0.84 . Масс-спектр, m/z (Iотн (%)): 352 [М+H]+ (75), 272 [C15H10FNO3 + H]+ (31), 226 [C14H10FNO – H]+ (100). ИК-спектр (KBr) ν, см-1: 3108–2855 (С—Н); 1744 (С=Оэфирн.); 1638 (С=Оакридона); 1603, 1499, 1463 (С-Сар). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 5.27 (с, 2 Н, C(2a)H2); 5.30 (с, 2 Н, C(1a)H2); 6.50 (т, 1 H, C(2b)H, J = 3.0, J =1.8); 6.60 (д, 1 H, C(1b)H, J = 2.9); 7.31 – 7.35 (м, 1 H, C(2)H); 7.39 (т, 1 H, C(7)H, J = 7.4); 7.61 (д, 1 H, C(5)H, J = 8.8); 7.67 (дд, 1 H, C(3)H, J = 15.3, J = 7.8); 7.73 (с, 1 H, C(3b)H); 7.81 (т, 1 H, C(6)H, J = 7.8); 8.15 (д, 1 H, C(1)H, J = 8.1); 8.28 (д, 1 H, C(8)H, J = 8.1).
Фуран-2-илметил(2-фтор-6-нитро-9-оксоакридин-10(9H)-ил)ацетат (1c)
Кристаллическое вещество темно-оранжевого цвета. Выход: 74 %, т.пл. 153-154 °С. Rf = 0.86. Масс-спектр, m/z (Iотн (%)): 397 [М+H]+ (64), 271 [C14H9FN2O3 – H]+ (100). ИК-спектр (KBr) ν, см-1: 3103–2857 (С—Н); 1728 (С=Оэфирн.); 1651 (С=Оакридона); 1611, 1483, 1462 (С-Сар), 1534 (NO2). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 5.24 (с, 2 Н, C(2a)H2); 5.67 (с, 2 Н, C(1a)H2); 6.47 (т, 1 H, C(2b)H, J = 3.3, J =1.5); 6.56 (д, 1 H, C(1b)H, J = 3.3); 7.69 (с, 1 H, C(3b)H); 7.78 – 7.82 (м, 2 Н, C(3)H, C(4)H); 7.98 (д, 1 H, C(1)H, J = 8.4); 8.05 (д, 1 H, C(7)H, J = 8.8); 8.47 (с, 1 H, C(5)H); 8.51 (д, 1 H, C(8)H, J = 8.4).
Тетрагидрофуран-2-илметил(2-фтор-9-оксоакридин-10(9H)-ил)ацетат (2a)
Кристаллическое вещество бледно-желтого цвета. Выход: 77 %, т.пл. 147-148 °С. Rf = 0.79. Масс-спектр, m/z (Iотн (%)): 356 [М+H]+ (100), 272 [C15H10FNO3+H]+ (94), 226 [C14H10FNO – H]+ (35). ИК-спектр (KBr) ν, см-1: 3070–2855 (С—Н); 1751 (С=Оэфирн.); 1627 (С=Оакридона); 1603, 1493, 1466 (С-Сар), 1074 (С-О-С в тетрагидрофуран. фрагменте). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.44 – 1.50 (м, 1 Н, С(2b)Н); 1.67 – 1.75 (м, 2 Н, С(2b)Н, С(3b)Н); 1.82 – 1.88 (м, 1 Н, С(3b)Н); 3.55 – 3.60 (м, 2 Н, С(4b)Н2); 4.01 – 4.05 (м, 1 Н, С(1b)Н); 4.08 – 4.11 (м, 1 Н, С(2a)Н); 4.17 (дд, 1 Н, С(2a)Н, J=11.5, J=3.6); 5.49 (с, 2 Н, С(1a)Н2); 7.37 (т, 1 Н, С(7)Н, J=7.6); 7.66 (д, 1 Н, С(4)Н, J=8.6); 7.71 – 7.78 (м, 2 Н, С(3)Н, С(5)Н); 7.82 (т, 1 Н, С(6)Н, J=7.6); 7.98 (дд, 1 Н, С(1)Н, J=8.6, J=2.6); 8.33 (д, 1 Н, С(8)Н, J=8.1).
Тетрагидрофуран-2-илметил(4-фтор-9-оксоакридин-10(9H)-ил)ацетат (2b)
Кристаллическое вещество желтого цвета. Выход: 82 %, т.пл. 142-143 °С. Rf = 0.80. Масс-спектр, m/z (Iотн (%)): 356 [М+H]+ (100), 272 [C15H10FNO3+H]+ (81), 226 [C14H10FNO – H]+ (20). ИК-спектр (KBr) ν, см-1: 3071–2847 (С—Н); 1750 (С=Оэфирн.); 1640 (С=Оакридона); 1601, 1498, 1461 (С-Сар), 1084 (С-О-С в тетрагидрофуран. фрагменте). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.53 – 1.59 (м, 1 Н, С(2b)Н); 1.73 – 1.78 (м, 2 Н, С(2b)Н, С(3b)Н); 1.89 – 1.95 (м, 1 Н, С(3b)Н); 3.61 – 3.69 (м, 2 Н, С(4b)Н2); 4.06 – 4.09 (м, 1 Н, С(1b)Н); 4.14 – 4.17 (м, 1 Н, С(2a)Н); 4.24 (д, 1 Н, С(2a)Н, J=11.5); 5.28 (с, 2 Н, С(1a)Н2); 7.32 – 7.35 (м, 1 Н, С(2)Н); 7.39 (т, 1 Н, С(7)Н, J=7.4); 7.62 (д, 1 Н, С(5)Н, J=8.6); 7.69 (дд, 1 Н, С(3)Н, J=15.1, J=7.8); 7.82 (т, 1 Н, С(6)Н, J=7.5); 8.15 (д, 1 Н, С(1)Н, J=7.7); 8.29 (д, 1 Н, С(8)Н, J=7.9).
2-(2-метил-5-нитро-1H-имидазол-1-ил)этил(2-фтор-9-оксоакридин-10(9H)-ил)ацетат (3a)
Кристаллическое вещество бледно-желтого цвета. Выход: 62 %, т.пл. 224-225 °С. Rf = 0.68. Масс-спектр, m/z (Iотн (%)): 425 [М+H]+ (100), 298 [C17H14FNO3 – H]+ (65), 272 [C15H10FNO3 + H]+ (67), 226 [C14H10FNO – H]+ (29), 212 [C13H8FNO – H]+ (8). ИК-спектр (KBr) ν, см-1: 3129 – 2847 (С—Н); 1742 (С=Оэфирн.); 1619 (С=Оакридона); 1601, 1493, 1462 (С=С, С=N); 1526 (NO2). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.28 (с, 3 Н, CH3); 4.53 (т, 2 Н, С(3a)Н2, J=5.1); 4.58 (т, 2 Н, С(2a)Н2, J=5.0); 5.39 (с, 2 Н, С(1a)Н2); 7.38 (т, 1 Н, С(7)Н, J=7.5); 7.50 (д, 1 Н, С(4)Н, J=8.7); 7.58 – 7.64 (м, 2 Н, С(3)Н, С(5)Н); 7.68 (т, 1 Н, С(6)Н, J=7.8); 7.79 (дд, 1 Н, С(1)Н, J=8.8, J=2.7); 7.98 (с, 1 Н, С(1b)Н); 8.33 (д, 1 Н, С(8)Н, J=8.0).
2-(2-метил-5-нитро-1H-имидазол-1-ил)этил(4-фтор-9-оксоакридин-10(9H)-ил)ацетат (3b)
Кристаллическое вещество светло-коричневого цвета. Выход: 65 %, т.пл. 207-208 °С. Rf = 0.71. Масс-спектр, m/z (Iотн (%)): 425 [М+H]+ (95), 298 [C17H14FNO3 – H]+ (100), 272 [C15H10FNO3 + H]+ (28), 254 [C15H10FNO2 – H]+ (12), 226 [C14H10FNO – H]+ (73), 212 [C13H8FNO – H]+ (13). ИК-спектр (KBr) ν, см-1: 3129 – 2856 (С—Н); 1738 (С=Оэфирн.); 1636 (С=Оакридона); 1610, 1601, 1497, 1462 (С=С, С=N); 1519 (NO2). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.26 (с, 3 Н, CH3); 4.58 (т, 2 Н, С(3a)Н2, J=5); 4.62 (т, 2 Н, С(2a)Н2, J=4.8); 5.18 (с, 2 Н, С(1a)Н2); 7.32 – 7.35 (м, 1 Н, С(2)Н); 7.39 (т, 1 Н, С(7)Н, J=7.4); 7.49 (д, 1 Н, С(5)Н, J=8.8); 7.63 (дд, 1 Н, С(3)Н, J=15.2, J=7.8); 7.78 (т, 1 Н, С(6)Н, J=7.8); 7.95 (с, 1 Н, С(1b)Н); 8.14 (д, 1 Н, С(1)Н, J=7.8); 8.28 (д, 1 Н, С(8)Н, J=7.8).
2-(4-метил-1,3-тиазол-5-ил)этил(4-фтор-9-оксоакридин-10(9H)-ил)ацетат (4)
Кристаллическое вещество желтого цвета. Выход: 80 %, т.пл. 146-147 °С. Rf = 0.76. Масс-спектр, m/z (Iотн (%)): 397 [М+H]+ (100), 272 [C15H10FNO3+H]+ (88), 226 [C14H10FNO – H]+ (30), 213 [C13H8FNO]+ (7). ИК-спектр (KBr) ν, см-1: 3073–2855 (С—Н); 1753 (С=Оэфирн.); 1647 (С=Оакридона); 1602, 1501, 1462 (С-Сар); 1412 (тиазольн. кольцо). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.26 (с, 3 Н, CH3); 3.15 (т, 2 Н, С(3a)Н2, J=6.3); 4.39 (т, 2 Н, С(2a)Н2, J=6.3); 5.23 (с, 2 Н, С(1a)Н2); 7.32 – 7.36 (м, 1 Н, С(2)Н); 7.39 (т, 1 Н, С(7)Н, J=7.4); 7.51 (д, 1 Н, С(5)Н, J=8.8); 7.66 (дд, 1 Н, С(3)Н, J=15.0, J=7.9); 7.80 (т, 1 Н, С(6)Н, J=7.9); 8.15 (д, 1 Н, С(1)Н, J=8.1); 8.29 (д, 1 Н, С(8)Н, J=7.9); 8.82 (с, 1 Н, С(1b)Н).
2-(2-фтор-9-оксоакридин-10(9H)-ил)-N-(1,3-тиазол-2-ил)ацетамид (5)
Кристаллическое вещество бледно-желтого цвета. Выход: 89 %, т.пл. 299-300 °С. Rf = 0.81. Масс-спектр, m/z (Iотн (%)): 354 [М+H]+ (100), 254 [C15H10FNO2 – H]+ (100). ИК-спектр (KBr) ν, см -1: 3329 (N—Н); 3164 – 2851 (С—Н); 1683 (С=Оамидн.); 1620 (С=Оакридона); 1603, 1564, 1487, 1462 (С-Сар). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 5.54 (с, 2 Н, С(1a)Н2); 7.26 (д, 1 Н, С(2b)Н, J=3.5); 7.37 (т, 1 Н, С(7)Н, J=7.1); 7.53 (д, 1 Н, С(1b)Н, J=3.5); 7.67 (д, 1 Н, С(4)Н, J=8.4); 7.74 (д, 1 Н, С(5)Н, J=8.6); 7.78 – 7.85 (м, 2 Н, С(6)Н, С(3)Н); 8.00 (дд, 1 Н, С(1)Н, J=7.6, J=2.8); 8.35 (д, 1 Н, С(8)Н, J=7.5); 12.76 (с, 1 Н, NH).
4-(3H-1,2-дитиол-3-тион-5-ил)фенил(2-фтор-9-оксоакридин-10(9H)-ил)ацетат (6)
Кристаллическое вещество темно-оранжевого цвета. Выход: 71 %, т.пл. 216-217 °С. Rf = 0,84. Масс-спектр, m/z (Iотн (%)): 480 [М+H]+ (100), 226 [C14H10FNO – H]+ (10). ИК-спектр (KBr) ν, см-1: 3061–2855 (С—Н); 1753 (С=Оэфирн.); 1642 (С=Оакридона); 1603, 1485, 1466 (С-Сар). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 5.79 (с, 2 Н, CH2); 7.41 (т, 1 Н, С(7)Н, J = 7.2); 7.47 (д, 2 H, C(1а)H, C(2а)H, J = 8.3); 7.76 – 7.80 (м, 1 Н, C(3)H); 7.83 (с, 1 Н, C(5а)H); 7.87 – 7.90 (м, 2 Н, C(4)H, C(5)H); 7.98-8.03 (м, 4 H, C(1)H, C(6)H, C(3а)H, C(4а)H); 8.36 (д, 1 H, C(8)H, J = 8.0).
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации
Список литературы
- Kudryavtseva T.N., Bogatyrev K.V., Sysoev P.I., Yar Zar Htun, Klimova L.G. Synthesis and study of antibacterial activity of some fluorosubstituted acridones derivatives // Fluorine notes: online journal. 2013. N 2 (87), URL: /public/2013/2_2013/letters/rusindex.html (Usage date 11.04.2014).
- US Pat. 5856347 (1999).
- Vukovic N., Sukdolak S., Solujic S., Milosevic T. Synthesis and antimicrobial evaluation of some novel 2-aminothiazole derivatives of 4-hydroxy-chromene-2-one // Archiv der Pharmazie. 2008. N 8. P. 491 – 496.
- Kleemann A., Engel J. Pharmaceutical Substances. Stuttgart - New York: Thieme, 2001. 2409 с.
- US Pat. 2013/0259947 A1 (2013).
- Beena, Kumar N., Rohilla R.K., Roy N., Rawat D.S. Synthesis and antibacterial activity evaluation of metronidazole–triazole conjugates // Bioorg. Med. Chem. Let. 2009. N 5. P. 1396–1398.
- Antonov E. A., Zhirov A. A., Kirsanov A. T., Krivolapov Yu. A., Sorokin A. A., Markovich Yu. D., Panfilov A. V. Synthesis of 5-(2-chloroethyl)-4-methylthiazole using the reaction of 5-(2-hydroxyethyl)-4-methylthiazole with phosphorus pentachloride // Pharm. Chem. J. 1999. N 33. P. 658-660.
- Lowe G., Potter B.V. L. Bacteriostatic activity of fluoro-analogues of 5-(2-hydroxyethyl)-4-methylthiazole, a metabolic intermediate in the biosynthesis of thiamine // J. Chem. Soc., Perkin Trans. 1980.N 1. P. 2026-2028.
- Li L., Rossoni G., Sparatore A., Lee L.C., Soldato P. D., Moore P. K. Anti-inflammatory and gastrointestinal effects of a novel diclofenac derivative // Free Radical Biology & Medicine. 2007. N 5. P. 706–719.
- Kodela R., Chattopadhyay M., Kashfi K. NOSH-Aspirin: A novel nitric oxide−hydrogen sulfide-releasing hybrid: a new class of anti-inflammatory pharmaceuticals // Med. Chem. Lett. 2012. N 3. P. 257−262.
- Perrino E., Cappelletti G., Tazzari V., Giavini E., Soldato P.D., Sparatore A. New sulfurated derivatives of valproic acid with enhanced histone deacetylase inhibitory activity // Bioorg. Med. Chem. Let. 2008. N 6. P. 1893–1897.
- Milazzo I., Blandino G., Caccamo F., Musumeci R., Nicoletti G., Speciale A. Faropenem, a new oral penem: antibacterial activity against selected anaerobic and fastidious periodontal isolates // Journal of Antimicrobial Chemotherapy. 2003. N 3. P. 721–725.
- Hao J., Chen B., Yao Y., Hossain M., Nagatomo T., Yao H., Kong L., Sun H. Practical access to four stereoisomers of naftidrofuryl and their binding affinity towards 5-hydroxytryptamine 2A receptor // Bioorg. Med. Chem. Let. 2012. N 10. P. 3441–3444.
- Богатырев К. В., Кудрявцева Т. Н., Бушина Л. Г., Климова Л.Г. Синтез и изучение антимикробной активности новых производных акридонкарбоновых кислот // Ученые записки. Электронный научный журнал Курского государственного университета. 2013.N 3. Том 2. URL: http://scientific-notes.ru/pdf/032-018.pdf (дата обращения 1.04.2014)
Статья рекомендована к публикации членом редколлегии проф. Елеевым А.Ф.
Fluorine Notes, 2014, 94, 3-4


