Поступило в редакцию: февраль 2014
УДК 542.955 : 547.513'116 : 547.514.721 : 547.722.1
Fluorine Notes, 2014, 93, 5-6
Перфторциклобутен и его димеры в реакции Дильса-Альдера с циклопентадиеном и фураном. Новые данные
А. Ю. Волконский,* Э. М. Каграманова, Е. И. Мысов , Н. Д. Каграманов
Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений
им. А.Н.Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова,
д. 28
e-mail: volkonskii@ineos.ac.ru
Аннотация: Фторированные норборнены и 7-оксанорборнен, содержащие перфторциклобутановые фрагменты, синтезированы по реакции Дильса-Альдера из перфторциклобутена, либо димеров перфторциклобутена и циклопентадиена или фурана.
Ключевые слова: перфторциклобутен, димеры перфторциклобутена, циклопентадиен, фуран, реакция Дильса-Альдера.
Фторсодержащие полимеры на основе норборнена и его аналогов оказались перспективными материалами для экстремальной ультрафиолетовой литографии (см., напр., [1, 2]), а также для создания газопроницаемых [3] и ион-селективных [4] мембран. В настоящей работе приводятся новые данные по синтезу фторсодержащих норборненов (1-3) и 7-оксанорборнена (4) (см. схему 1), являющихся потенциальными мономерами для получения подобных полимеров.
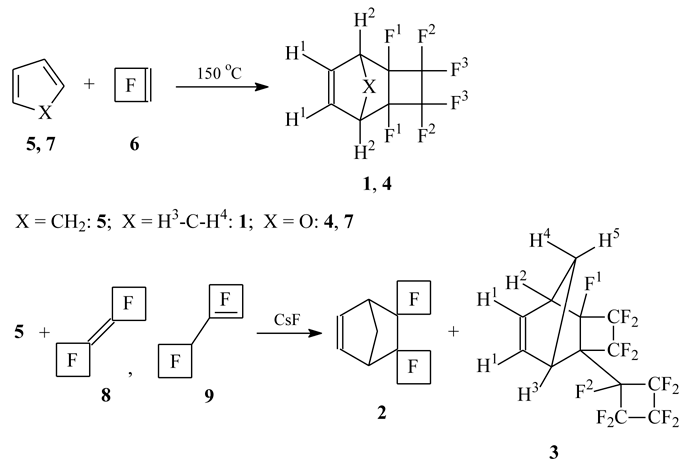
Схема 1
Следует заметить, что в литературе имеются единичные сведения о данных соединениях. Так, в публикации [5] декларировалось получение гексафтортрициклононена (1), а в статье [6] сообщалось о его гидроформилировании. Однако ни в одной из них нет ни детального описания синтеза соединения (1), ни его характеристик.
Трициклононен (1) был получен нами в результате продолжительного нагревания в автоклаве
без растворителя циклопентадиена (ЦПД) (5) с избытком перфторциклобутена (ПФЦБ) (6) с выходом 34% в виде смеси эндо- и экзо-изомеров (16:1). Аналогично, нагреванием фурана (7) с избытком ПФЦБ (6) был синтезирован также
9-оксатрициклононен (4), выделенный
с выходом 23%. Низкий выход продуктов объясняется в первом случае необходимостью глубокой
очистки целевого трициклононена (1) от примеси дициклопентадиена (ДЦПД), а во втором
- тем, что в условиях реакции соединение (4) в свою очередь вступает в реакцию
[2+4]-циклоприсоединения с фураном (7) (данные ЯМР-спектроскопии и хромато-масс-спектрометрии
не приводятся).
В литературе описано получение 9-оксатрициклононена (4) нагреванием эфирного раствора эквимолярной смеси фурана (7) и ПФЦБ (6) при 50-60 °С [7]. Нам не удалось повторить этот опыт: при 50-100 °С реакция практически не шла, и лишь при 150 °С конверсия фурана (7) составила около 10% через 19 ч. Хотя температура плавления и параметры спектров ЯМР 1Н и 19F полученного нами соединения отличаются от литературных данных [7], совокупность его спектральных характеристик (ЯМР, КР, масс-спектр, см. табл. 1-3) позволяет приписать ему структуру [2+4]-циклоаддукта (4).
В литературе описано также получение диспиронорборнена (2) взаимодействием ЦПД (5) с димером ПФЦБ (8), либо смесью димеров ПФЦБ (8/9) в присутствии CsF [8, 9].
При этом авторы утверждали, что в реакцию Дильса-Альдера может вступать только перфторбициклобутилиден
(8), тогда как олефин (9) остается инертным, и в присутствии CsF для него имеет
место лишь изомеризация в димер (8) [9]. В результате более тщательных очистки и изучения
продуктов реакции нами установлено, что при нагревании ЦПД (5) со смесью димеров ПФЦБ
(8/9)* в присутствии CsF образуются [2+4]-циклоаддукты из обоих олефинов: диспиронорборнен
(2) и
2-нонафторциклобутилзамещенный трициклононен (3), при этом выход
диспиронорборнена (2) всегда больше при любом соотношении исходных димеров (8/9).
Кроме того оказалось, что чистый диспиронорборнен (2) является твердым веществом,
а не жидкостью, как это сообщалось в [9]**.
Полимеризация синтезированных нами фторированных норборненов (1, 2), а также
7-оксанорборнена
(4) была исследована в Филиппс-университете г. Марбурга (ФРГ) в группе профессора
Хайтца [10].
Экспериментальная часть
Спектры ЯМР 1H и 19F (внешний эталон CF3COOH) зарегистрированы на спектрометре “Bruker WP-200SY” в CDCl3, спектры КР - на спектрометре “Ramanor HG-2S”, масс- и хромато-масс-спектры – на масс-спектрометрах “VG 7070E” и “Polaris/GCQ” (ЭУ, 70 эВ). Препаративная ГЖХ (ПГЖХ) проводилась при 150 °С на колонках QF1 на хромосорбе (длина 4 м, диаметр 25 мм) или FS1265 на хромосорбе (длина 3.6 м, диаметр 25 мм).
ЦПД (5) и фуран (7) получали пиролизом ДЦПД и пирослизевой кислоты соответственно и хранили при -78 °С. ПФЦБ (6) [11] и димеры ПФЦБ (8/9) с примесью моногидроциклоалкана (10) [12] синтезировали по известным методикам, состав смеси определяли по данным ЯМР и ГЖХ.
Характеристики синтезированных соединений представлены в таблицах 1-3.
2,3,3,4,4,5-Гексафтортрицикло[4.2.1.02,5]нонен-7 (1)
Смесь 5.93 г (89.7 ммоля) ЦПД (5), 18.65 г (115.0 ммоля) ПФЦБ (6) и 0.2 г гидрохинона нагревали в автоклаве 72 ч при 150 °С. После охлаждения низкокипящие вещества отгоняли, остаток фильтровали и промывали автоклав небольшим количеством эфира. Перегонкой объединенных фильтратов получено 11.94 г (58%) циклоаддукта (1) чистотой ≥98%, примесь ДЦПД – 1.2% (ЯМР, ГЖХ), т.кип. 58-59 °С (20 Торр). ПГЖХ (QF1) перегнанного продукта выделено 6.89 г (34%) трициклононена (1) в виде бесцветной жидкости, представляющей собой смесь эндо/экзо-изомеров (16/1), чистота ≥99.9%, содержание ДЦПД ≤0.01% (ЯМР, ГЖХ).
5-Норборнен-2-спиро-1’-(2’,2’,3’,3’,4’,4’-гексафторциклобутан)-3-спиро-1”-(2”,2”,3”,3”,4”,4”-гексафторциклобутан) (2) и 2-гептафторциклобутил-3,3,4,4,5-пентафтортрицикло[4.2.1.02,5]нонен-7 (3).
В запаянной стеклянной ампуле нагревали при 80 °С 1.78 г (27.0 ммоля) ЦПД (5), 6.84 г смеси димеров ПФЦБ (8/9) и моногидроциклоалкана (10) [(8)/(9)/(10) = 1.0/0.51/0.15; 20.7 ммоля в пересчете на C8F12] и 3.24 г (21.3 ммоля) свежепрокаленного CsF в течение 16 ч, периодически встряхивая. По окончании реакции надосадочная жидкость помимо других компонентов содержала циклоаддукты (2) и (3) в соотношении 4.4:1.0 (ЯМР, ГЖХ).
Аналогично нагревали 6 ч 3.19 г (48.3 ммоля) ЦПД (5), 11.11 г смеси димеров ПФЦБ (8/9) и моногидроциклоалкана (10) [(8)/(9)/(10) = 1.0/0.82/0.33; 33.7 ммоля в пересчете на C8F12] и 7.37 г (48.5 ммоля) CsF, а также 0.45 г (6.82 ммоля) ЦПД (5), 1.49 г смеси димеров ПФЦБ (8/9) и моногидроциклоалкана (10) [(8)/(9)/(10) = 1.0/4.5/3.9; 4.39 ммоля в пересчете на C8F12] и 1.18 г (7.76 ммоля) CsF. Полученные растворы помимо других компонентов содержали циклоаддукты (2) и (3) в соотношении ~2:1 (ЯМР, ГЖХ).
Реакционные смеси фильтровали, осадок промывали эфиром, объединенные фильтраты упаривали и остаток перегоняли, собирая фракцию с т.кип. 61-66 °С (5 Торр). ПГЖХ (FS1265) перегнанного продукта получено 12.83 г (56%) циклоаддукта (2) в виде белого твердого вещества, чистота ≥99%, содержание ДЦПД ≤0.01% (ЯМР, ГЖХ), а также 2.04 г (9%) циклоаддукта (3) в виде белого легкоплавкого твердого вещества, чистота ≥99% (ЯМР, ГЖХ).
2,3,3,4,4,5-Гексафтор-9-оксатрицикло[4.2.1.02,5]нонен-7 (4)
Смесь 9.6 г (0.141 моля) фурана (7) и 44.7 г (0.276 моля) ПФЦБ (6) нагревали в автоклаве 72 ч при 150 °С. После охлаждения низкокипящие вещества отгоняли, остаток растворяли в эфире и фильтровали. Аналогично получали эфирный раствор циклоаддукта (4) из 4.4 г (0.065 моля) фурана (7) и 32.4 г (0.200 моля) ПФЦБ (6). Объединенные эфирные растворы упаривали, перегонкой остатка получено 11.0 г (23%) 9-оксатрициклононена (4) в виде бесцветной жидкости, застывающей в белую кристаллическую массу, чистота ≥99%.
Таблица 1. Температуры кипения и плавления, спектры КР и данные элементного анализа синтезированных соединений.
|
Соединение |
Т. кип./°С (р/Торр) [т. пл./°С] |
Спектр КР, ν/см-1 |
Найдено (%) |
Брутто-формула |
||
|
C |
H |
F |
||||
|
1 |
57.5 (20) |
1569.0 оч.с (С=С) |
47.3 47.4 |
2.50 2.65 |
50.2 50.0 |
С9H6F6 |
|
2 |
71.5-72 (7) [52-53]a |
- |
- |
- |
- |
- |
|
3 |
[31-33] |
1569.2 ср (С=С) |
40.0 40.0 |
1.64 1.55 |
58.2 58.4 |
C13H6F12 |
|
4 |
68-69 (20) [50-51.5]b |
1568.5 оч.с (С=С) |
41.9 41.8 |
1.78 1.75 |
49.7 49.5 |
C8H4F6O |
a Бесцветная жидкость [9]. b Т.пл. 59 °С [7].
Таблица 2. Спектры ЯМР 1Н и 19F синтезированных соединений.
|
Соединение |
δ, м.д. (J/Гц) |
|
|
1H |
19F |
|
|
1 эндо-изомер |
1.71 (д.т.т, 1H, H(4), 2JH(4),H(3) = 11.6, 4JH(4),F(1) = 6.8, 5JH(4),F(2 или 3) = 2.1); 1.89 (уш.д, 1H, H(3), 2JH(3),H(4) = 11.6); H(3),H(4) – AB-система; 3.38 (с, 2H, H(2)); 6.54 (с, 2H, H(1)) |
-112.5 (уш.д.т, 2F, F(1), 4JF(1),H(4) ≈ 3JF(1),F(2 или 3) ≈ 6.5); -51.3 и -50.4 (оба д.м, оба 2F, F(2) и F(3), АВ-система, JAB = 225) |
|
1 экзо- изомер |
2.24 (уш.д, 1H, H(3), 2JH(3),H(4) = 9.8); 2.39 (уш.д.м, 1H, H(4), 2JH(4),H(3) = 9.8); H(3),H(4) – AB-система; 3.22 (уш.м, 2H, H(2)); 6.18 (уш.м, 2H, H(1)) |
-110.2 (м, 2F, F(1)); -49.7 и -47.8 (оба д.м, оба 2F, F(2) и F(3), АВ-система, JAB = 225) |
|
3 |
1.72 (уш.д.м, 1H, H(5), 2JH(5),H(4) = 11.6); 2.16 (уш.д, 1H, H(4), 2JH(4),H(5) = 11.6); H(4),H(5) – AB-система; 3.47 и 3.56 (оба уш.с, оба 1H, H(2) и Н(3)); 6.63 (уш.с, 2H, H(1)) |
-101.5 (уш.д.д, 1F, F(1), Jд = 51.5, |
|
4 |
5.28 (уш.с, 2Н, Н(2)); 6.84 (уш.с, 2Н, Н(1))а |
-114.5 (м, 2F, F(1)); -52.5 (м, 4F, |
а Спектры ЯМР 1Н и 19F ср. лит. [7].
Таблица 3. Масс-спектры синтезированных соединений.
|
Соединение |
m/z (Iотн. (%)) |
|
1 эндо-изомер |
228 [M]+ (8.7); 209 [M – F]+ (0.6); 189 [C9H5F4 и/или C6H3F6]+ (1.7); 169 [C6H2F5]+ (2.6); 163 [C7H3F4]+ (3.0); 145 [C7H4F3]+ (3.5); 128 [M – C2F4]+ (8.7); 127 |
|
1 экзо-изомер |
228 [M]+ (15.7); 209 [M – F]+ (1.1); 189 [C9H5F4 и/или C6H3F6]+ (2.4); 177 |
|
2 |
390 [M]+ (2.3); 351 [C13H5F10 и/или C10H3F12]+ (3.2); 331 [C13H4F9 и/или C10H2F11]+ (5.6); 311 [C13H3F8 и/или C10HF10]+ (6.6); 290 [M – C2F4]+ (22.8); 289 [M – C2HF4]+ (25.4); 275 [C7HF10]+ (16.4); 269 [C11H4F7]+ (23.2); 239 [M – C3HF6]+ (28.0); 231 [C8H2F7]+ (22.7); 221 [M – C3F7]+ (26.6); 219 [C10H4F5]+ (41.4); 201 [C10H5F4]+ (49.4); 200 [C10H4F4]+ (33.9); 190 [C9H6F4]+ (30.9); 189 [C9H5F4]+ (36.4); 170 [C6H3F5]+ (43.0); 169 [C6H2F5]+ (50.9); 151 [C6H3F4]+ (40.1); 66 [C5H6]+ (100); 65 [C5H5]+ (39.4)a |
|
3 |
390 [M]+ (6.1); 371 [M – F]+ (2.5); 351 [C13H5F10 и/или C10H3F12]+ (4.6); 331 [C13H4F9 и/или C10H2F11]+ (5.8); 311 [C13H3F8 и/или C10HF10]+ (6.1); 301 [C12H5F8]+ (6.8); 290 [M – C2F4]+ (17.2); 289 [M – C2HF4]+ (27.6); 269 [C11H4F7]+ (20.2); 239 [M – C3HF6]+ (25.9); 219 [C10H4F5]+ (39.7); 201 [C10H5F4]+ (44.0); 200 [C10H4F4]+ (32.7); 189 [C6H3F6]+ (25.6); 170 [C6H3F5]+ (46.0); 169 [C6H2F5]+ (46.6); 151 [C6H3F4]+ (31.6); 115 [C6H5F2]+ (37.9); 66 [C5H6]+ (100); 65 [C5H5]+ (44.8) |
|
4 |
191 [C8H3F4O и/или C5HF6O]+ (0.2); 181 [C7H2F5]+ (0.6); 163 [C4HF6]+ (3.4); 132 [C3HF5]+ (4.3); 114 [C3H2F4]+ (3.0); 101 [C2HF4]+ (4.8); 93 [C3F3]+ (3.6); 75 [C3HF2]+ (4.8); 68 [C4H4O]+ (100); 57 [C3H2F]+ (3.4); 51 [CHF2]+ (3.4); 40 [C3H4]+ (6.1); 39 [C3H3]+ (8.7); 31 [CF]+ (5.5); 29 [CHO]+ (6.9) |
a Масс-спектр ср. лит. [9].
* Использованные в настоящей работе смеси димеров ПФЦБ (8/9) содержали также некоторое количество продукта гидрофторирования – 1-гидро-1-нонафторциклобутил-2,2,3,3,4,4-гексафторциклобутана (10), который в присутствии CsF количественно дегидрофторируется in situ до фторолефинов (8/9)
** Параметры спектров ЯМР 1Н и 19F полученного в настоящей работе диспиронорборнена (2) практически совпадают с литературными данными [9]
Список литературы
- C. Chang, D. Barnes, L. D. Seger, L. F. Rhodes, R. P. Lattimer, G. M. Benedikt, J. Photopolym. Sci. Technol., 2012, 25, 161-169.
- T. Yamashita, M. Morita, Y. Tanaka, J. J. Santillan, T. Itani, J. Photopolym. Sci. Technol., 2011, 24, 165-172.
- J. Vargas, A. A. Santiago, M. A. Tlenkopatchev, M. Lopez-Gonzalez, E. Riande, J. Membr. Sci., 2010, 361, 78-88.
- A. A. Santiago, J. Vargas, J. Cruz-Gomez, M. A. Tlenkopatchev, R. Gavino, M. Lopez-Gonzalez, E. Riande, Polymer, 2011, 52, 4208-4220.
- В. А. Альбеков, В. Н. Миронов, А. Ф. Бенда, П. Ф. Поташников, Г. А. Сокольский, Тез. докл. V Всесоюз. конф. по химии фторорган. соед. (20-22 мая 1986 г.), Москва, 1986, с. 3 [V. A. Al’bekov, V. N. Mironov, A. F. Benda, P. F. Potashnikov, G. A. Sokol’sky, Abstr. of V National Organofluorine Conference (May 20-22 1986), Moscow, 1986, p. 3].
- И. И. Керов, В. Л. Яшкир, Г. А. Корнеева, И. И. Крылов, Е. В. Сливинский, А. В. Игнатенко, Нефтехимия, 1998, 38, 171-178 [I. I. Kerov, V. A. Yashkir, G. A. Korneeva, I. I. Krylov, E. V. Slivinskii, A. V. Ignatenko, Petroleum Chemistry, 1998, 38, 156-163 (Engl. Transl.)].
- В. А. Альбеков, А. Ф. Бенда, А. Ф. Гонтарь, Г. А. Сокольский, И. Л. Кнунянц, Изв. АН СССР. Сер. хим., 1988, 897-900 [V. A. Al’bekov, A. F. Benda, A. F. Gontar’, G. A. Sokol’sky, I. L. Knunyants, Bull. Acad. Sci. USSR, Div. Chem. Sci., 1988, Vol. 37, No. 4 (Engl. Transl.)].
- R. D. Chambers, J. R. Kirk, G. Taylor, R. L. Powell, J. Fluor. Chem., 1983, 22, 393-395.
- A. E. Bayliff, M. R. Bryce, R. D. Chambers, J. R. Kirk, G. Taylor, J. Chem. Soc., Perkin Trans. 1, 1985, 1191-1193.
- T. Haselwander, Dissertation, Marburg, 1996.
- Синтезы фторорганических соединений, под ред. И. Л. Кнунянца и Г. Г. Якобсона, Химия, Москва, 1973, с. 46 [Syntheses of Organofluorine Compounds, Eds. I. L. Knunyants, G. G. Yakobson, Khimiya, Moscow, 1973, p. 46.]
- R. D. Chambers, G. Taylor, R. L. Powell, J. Chem. Soc., Perkin Trans. 1, 1980, 426-428.
Статья рекомендована к публикации членом редколлегии Д.х.н. Н.Д. Чканиковым
Fluorine Notes, 2014, 93, 5-6