Поступило в редакцию: декабрь 2013
УДК 547.464.2;547.539.1;632;954
Fluorine Notes, 2014, 92, 3-4
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ ФТОРСОДЕРЖАЩЕГО СТИМУЛЯТОРА РОСТА РАСТЕНИЙ "ФЛОРОКСАН"
О.Ю. Федоровский, И.С. Щелик, Н.Д. Каграманов, Н.Д. Чкаников
Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений
им. А.Н.Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова,
д. 28
e-mail: offskii@rambler.ru
Аннотация. Получен ряд новых производных фторсодержащего регулятора роста растений «флороксан».
Ключевые слова: фторорганические соединения, регулятор роста растений «флороксан», производные «флороксана», превращения замещённой 3,3,3-трифторпропионовой кислоты.
Поиск новых регуляторов роста растений - актуальная задача органического синтеза [1]. «Флороксан» (1) - перспективный фторсодержащий стимулятор роста растений, который в настоящее время внедряется в сельскохозяйственную практику [2]. К его преимуществам следует отнести крайне малую действующую концентрацию, низкую токсичность и легкую биодеградацию, и следовательно, ничтожно малое влияние на окружающую среду в сочетании с эффективным рост стимулирующим действием [3].
С целью получения еще более эффективных препаратов в настоящей работе были синтезированы различные производные (1). Первая группа превращений затрагивала фенильное кольцо, вторая сложноэфирную группу, третья – гидроксильную группу.
К первой группе реакций относится введение атомов галогенов: -Cl и –Br в фенильное кольцо. Обработкой «флороксана» (1) N-хлорсукцинимидом (NCS) в растворе четырёххлористого углерода и в присутствии триэтиламина (ТЭА) получено монохлорпроизводное (2) с высоким выходом (91%).
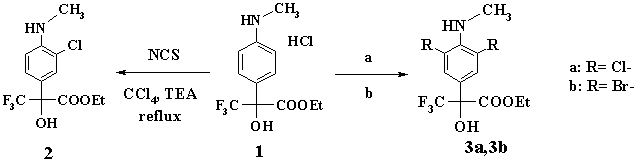
(Процедура (а): NCS, CCl4, кипячение. Процедура (b): Br2, AcOH, 0-5° С.)
Для получения 3,5-дихлорпроизводного (3а) в реакции использовали трёхкратный избыток NCS. Выход (3а) составил 72%. Бромированием флороксана молекулярным бромом в растворе уксусной кислоты получено 3,5-дибромпроизводное (3b) с хорошим выходом (60%).
Во второй группе реакций была получена аминогидроксикислота (4) омылением флороксана (1) в водно-диоксановом растворе в присутствии избытка NaOH. Выход (4) составил 84%.
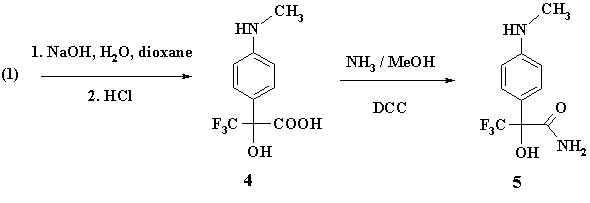
Далее, кислота (4) была переведена в амид (5) обработкой метанольным раствором аммиака (~15% масс.) в присутствии дициклогексилкарбодиимида (DCC), выход амида (5) составил 50%. Амид (5) так же был получен аммонолизом (1) водным раствором аммиака с лучшим выходом (73%).
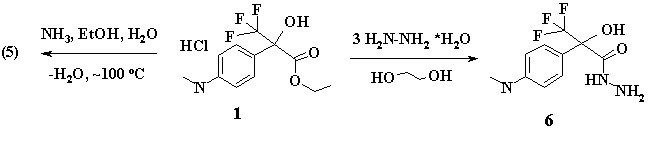
При кипячении (1) с трёхкратным избытком гидразингидрата получен карбогидразид (6) с выходом 62%.
Третья группа превращений имела целью получить алкильные производные по гидроксильной группе соединения (1), либо восстановить гидроксил (С-ОН) до образования (С-Н) связи. Для этого «флороксан» (1) обрабатывали тионилхлоридом в растворе хлороформа до образованием (7). Соединение (7) для дальнейших превращений было использовано без выделения. В последующих реакциях присутствие исходного (1) обнаружено не было, что свидетельствует о полноте его конверсии. Образование (7) было подтверждено данными масс-спектрометрии. Следует отметить, что хлорное производное (7) не стабильно, и в присутствии воды склонно к легкому гидролизу с отщеплением атома хлора и образованием исходного вещества (1).
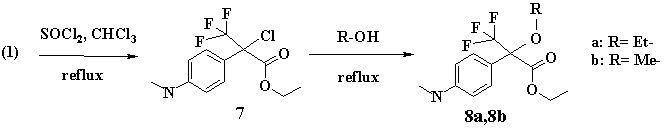
Так, кипячением хлорпроизводного (7) в этаноле получено этоксипроизводное флороксана (8а) с хорошим выходом (72%). Использование метанола привело к образованию метоксипроизводного (8б) с высоким выходом (75%).
Лёгкость нуклеофильного замещения атома хлора в данном положении, объясняется видимо, влиянием соседних акцепторных групп: трифторметильной и сложноэфирной, увеличивающих положительный заряд на бензильном углеродном атоме. Фенильное кольцо способствует стабилизации карбкатиона образованием парахиноидной структуры. Восстановление (C-Cl) связи соединения (7) проводили активированным металлическим цинком в растворе ледяной уксусной кислоты [4]. Из расчета на две стадии выход соединения (9) составил 78%.
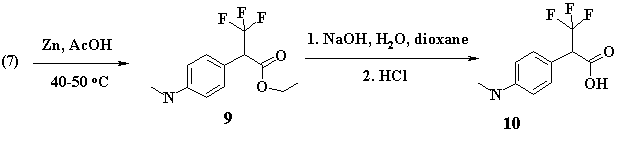
Щелочным омылением эфира (9) в водно-диоксановом растворе в присутствии гидроксида натрия была получена аминокислота (10) с хорошим выходом (67%) из расчёта на две стадии.
Дальнейшие пути модификации и поиска новых производных «флороксана» будут определены после проведения биологических испытаний новых полученных соединений.
Экспериментальная часть
Чистота и структуры полученных соединений подтверждены методами тонкослойной хроматографии, пластины Kieselgel 60 F254, ЯМР-спектроскопии Avance 300, для ядер 1H, 19F, и хроматомасс-спектрометрии Finnigan Polaris Q/Trace GC ultra, ионная ловушка, ЭУ 70Эв. Колонка: RTX-5ms, тип фазы: 5% phenylpolysilphenylene-siloxane.
Этиловый эфир 2-(3-хлор-4-метиламино-фенил)-3,3,3-трифтор-2-гидрокси пропионо-вой кислоты (2): К раствору 1г (0.0032моль) (1) в 50 мл CCl4 добавили 0.33г (0.0033моль) ТЭА и 0.43г (0.0032моль) NCS, кипятили с обратным холодильником в течение 2 часов, контроль за ходом реакции до исчезновения исходного (1) проводили методом ТСХ, элюент: хлороформ/этилацетат в соотношении 95/5. Выпавший после завершения реакции сукцинимид был отфильтрован, а раствор был упарен на роторном испарителе при пониженном давлении, упаренная масса была хроматографически очищена на 150г SiO2, элюент: хлороформ/петролейный эфир в соотношении 9/1, Rf=0.75. Получили 0.9г соединения (2), выход 91%. Медленно кристаллизующееся светло-жёлтое масло.
Спектр ЯМР-1Н: d1.2 ppm: 3H-t, j=7Hz, CH3; 2.76 ppm: 3H-d, j= 7Hz, N-CH3; 4.24 ppm: 2H-q, j= 7Hz, CH2; 5.8 ppm: 1H-m-уширенный, N-H; 6.65 ppm: 1H-d, j= 7.5Hz, Aryl; 7.28 ppm: 1H-dd, Jo= 7.5Hz, Jm= 0.13Hz, Aryl; 7.38 ppm: 1H-d, jm= 0.13Hz, Ar.; 7.65 ppm: 1H-c, OH.
Спектр ЯМР-19F: d2.48 ppm синглет, CF3.
Масс-спектр: m/z 311 [M]+ (33.2); 272 [С12H12ClFNO3]+ (3.2); 238 [C9H8ClF3NO]+, (100); 168 [M-CF3-CO2-H2O]+ (88.3); 141 [M-C5H5F3NO2]+ (23.2).
Этиловый эфир 2-(3,5-дихлор-4-метиламино-фенил)-3,3,3-трифтор-2-гидроксипропи-оновой кислоты (3а): К раствору 1г (0.0032моль) (1) в CCl4 добавили 1.3г (0.0096моль) NCS и кипятили в течение 4 часов. Контроль за ходом реакции до исчезновения исходного (1) проводили методом ТСХ, элюент: хлороформ/петролейный эфир в соотношении 9/1, Rf= 0.7. Процедура выделения и очистки (3а) аналогична процедуре для соединения (2). Получили 0.8г, выход 72%. Медленно кристаллизующееся светло-жёлтое масло.
Спектр ЯМР-1Н: d1.22 ppm: 3H-t, j=7Hz, CH3; 3.0 ppm: 3H-c, N-CH3; 4.27 ppm: 2H-q, j=7Hz, CH2; 5.39 ppm: 1H-уширенный, N-H; 7.39 ppm: 2H-c, Aryl; 7.96 ppm: 1H-c, -OH.
Спектр ЯМР-19F: d 2.51 ppm синглет, CF3.
Масс-спектр: m/z 345 [М]+ (30.2); 311 [C11H9Cl2F2NO3]+ (18.1); 272 [M-C3H5O2]+ (100).
Этиловый эфир 2-(3,5-Дибром-4-метиламино-фенил)-3,3,3-трифтор-2-гидрокси про-пионовой кислоты (3b): К раствору 1г (0.0032моль) (1) в ледяной уксусной кислоте 20мл при 0-5° С прибавляли 1.04г (0.0065моль) брома. Контроль за ходом реакции до исчезновения исходного (1) проводили методом ТСХ, элюент: хлороформ/петролейный эфир в соотношении 9/1, Rf=0.8. Затем, реакционная смесь была упарена при пониженном давлении и остаток перенесён в 50мл воды. рН водного раствора был доведен до 7 порционным прибавлением твёрдого NaHCO3. Выпавшие кристаллы были отфильтрованы, промыты водой и в дополнительной очистке не нуждались. Выход 3,5-дибромпроизводного (3b) составил 0.83г, 60%. Белое кристаллическое вещество, Тпл=135-138 ° С.
Спектр ЯМР-1Н: d1.22ppm: 3H-t, j=7Hz; 2.95ppm: 3H-d, j=7Hz, N-Me; 4.27ppm: 2H-q, j=7Hz, CH2; 5.00 ppm: 2H-q уширенный, j=7Hz, N-H; 7.62 ppm: 2H-s, уширенный, Ar; 8.00 ppm: 1H-s, уширенный, -OH.
Спектр ЯМР-19F: d2.56 ppm синглет уширенный, -CF3.
Масс-спектр: m/z 433 [М]+ (100.00); 362 [C9H8Br2F3NO]+ (62.5); 292 [C11H12Br2NO3]+ (82).
3,3,3,-Трифтор–2–гидрокси–2–(4-метиламино-фенил)-пропионовая кислота (4): К 20мл водно-диоксанового (в соотношении 1/1) раствора содержащему 2г (0.0064моль) (1) добавили 0.3г (0.007моль) (1.1 эквивалент) NaOH в 5 мл воды и кипятили в течение двух часов. Затем, реакционная масса была охлаждена, и диоксан был упарен на роторном испарителе при пониженном давлении. Полученная водорастворимая масса при охлаждении до 0-5° С была подкислена соляной кислотой (18%) до нейтрального рН, выпавшая кислота (4) была отфильтрована и промыта дистиллированной водой на фильтре. Выход (4) составил 1.3г, 84%. Светло-серое кристаллическое вещество, Тпл=162-167 ° С с разложением.
Спектр ЯМР-1Н: d2,6 ppm: 3H-d, N-CH3; 6.54 ppm: 2H-d, j= 7.5Hz, Aryl; 7.3 ppm: 2H-d, j= 7.5Hz, Aryl.
Спектр ЯМР-19F: d 2.52 ppm синглет, -CF3.
Масс-спектр: m/z 249[M]+ (9.1); 231 [M-H2O]+ (4.9); 204 [M-CHO2]+ (80.7); 134 [M-CHO2-CF3-H]+ (100); 107 [C7H9N]+ (37.5).
3,3,3-Трифтор-2-гидрокси-2-(4-метиламино-фенил)-пропионамид (5): Процедура 1. К раствору 0.5г (0.002моль) (4) в 15 мл метанола содержащего аммиак (~15% масс.) добавили 0.41г (0.002моль) DCC при комнатной температуре. На следующий день реакционная масса была упарена, твердый остаток очищен хроматографически на 150г SiO2, элюент: хлороформ/этилацетат в соотношении 8/2, Rf=0.25. выход амида (5) составил 0.25г, 50%.
Процедура 2. Кипячением с эффективным обратным холодильником в течение 3 часов 10мл спирта и 15 мл водно-аммиачного раствора содержащего 1г (0.0032моль) (1) получен амид (5). Контроль за прохождением реакции методом ТСХ, элюент: хлороформ/этилацетат в соотношении 8/2, Rf=0.25. После завершения реакции водно-спиртовой раствор был упарен на половину, при охлаждении из которого выпали кристаллы (5). Выход амида (5) составил 1.15г, 73%. Светло-серое кристаллическое вещество, Тпл=183-188 ° С.
Спектр ЯМР-1Н: d2.67 ppm: 3H-s, N-CH3; 5.75 ppm: 1H, уширен, NH; 6.49 ppm: 2H-d, j=8Hz, Aryl; 7.14 ppm 1H-s, уширен, -OH; 7.32 ppm: 2H-d, j=8Hz, Aryl, 7.52 ppm: 2H-s, уширен, -NH2.
Спектр ЯМР-19F: d 4.15 ppm синглет, -CF3.
Масс-спектр: m/z 248 [М]+ (18.5); 204 [C9H9F3NO]+ (87.5).
Гидразид 3,3,3-трифтор-2-гидрокси-2-(4-метиламинофенил) пропионовой кислоты (6): К раствору 10мл этиленгликоля содержащего 0.5г (0.0016моль) (1) добавили 0.25г (0.0048моль) гидразинмоногидрата и кипятили в течение трёх часов с обратным холодильником. Затем, реакционная масса была упарена на роторном испарителе при пониженном давлении, оставшуюся массу перенесли в 20мл воды и выпавшие кристаллы отфильтровали, промыли водой, в дополнительной очистке вещество не нуждалось. Выход соединения (6) составил 0.42г, 62%. Белое кристаллическое вещество, Тпл=151-155 ° С. На ТСХ элюент хлороформ/этилацетат в соотношении 85/15, Rf=0.15.
Спектр ЯМР-1Н: d2.64 ppm: 3H-d, j=5,5Hz, CH3; 4.32 ppm: 2H-s, NH2; 5.8 ppm: 1H-d, j=4Hz, NH; 6.49 ppm: 2H-d, j=9Hz, Aryl;; 7.2 ppm: 1H-s, OH; 7.34 ppm: 2H-d, j=9Hz, Aryl.
Спектр ЯМР-19F: d 3.96 ppm синглет, CF3.
Масс-спектр: m/z 263 [М]+ (8.4); 204 [C9H9F3NO]+ (61.2); 176 [C8H5F3O]+ (2.5).
Этиловый эфир 2-Хлор-3,3,3-трифтор-2-(4-метиламино-фенил)-пропионовой кислоты (7): К 20мл раствору хлороформа содержащего 2г (0.0064моль) (1) и каталитическое количество пиридина (50мг) при охлаждении до 0-5° С медленно по каплям добавили 1.52г (0.0128моль) свежеперегнанного тионилхлорида. Реакционную массу кипятили 4 часа с обратным холодильником и хлоркальциевой трубкой. Контроль за прохождением реакции проводили методом ТСХ, элюент: дихлорметан/петролейный эфир (40-70) в соотношении 1/1, Rf=0.5. Затем, реакционная масса была упарена на роторном испарителе при пониженном давлении до образования густого остатка, и повторно упарена с хлороформом для удаления следов тионилхлорида.
Масс-спектр: m/z 295 [М]+ (15.6); 260 [M-Cl]+ (42.6); 222 [M-C3H5O2]+ (100); 188 [M-C3H4O2-Cl]+ (76.9).
Этиловый эфир 2-этокси-3,3,3-трифтор-2-(4-метиламино-фенил)-пропионовой кислоты (8а): К полученному соединению (7) (0.0064моль) добавляли 20 мл абсолютного этанола и кипятили с обратным холодильником в течение 3 часов. Контроль за прохождением реакции проводили методом ТСХ, элюент: дихлорметан/петролейный эфир (40-70) в соотношении 1/1, Rf=0.75. Реакционная масса была упарена и твердый остаток очищен хроматографически на 150г SiO2, элюент: дихлорметан/петролейный эфир (40-70) в соотношении 1/1, Rf=0.75. выход (8а) составил 1.4г, 72% из расчёта на две стадии. Светло-жёлтое масло.
Спектр ЯМР-1Н: CDCl3: 1.28 ppm: 6H-t, j=5.5 Hz, 2-CH3; 2.84 ppm: 3H-s, N-Me; 3.54-3.79 ppm: 2H-m, j=7 Hz, -O-CH2-; 4.34 ppm: 2H-m, j=7 Hz, -O-CH2- сл. эфир; 6.56 ppm: 2H-d, j=10 Hz, Aryl; 7.35 ppm: 2H-d, j=10 Hz, Aryl.
Спектр ЯМР-19F: CDCl3: 5.45 ppm: s, -CF3.
Хромато-масс спектр: чистота ≥ 95%, время удержания вещества в капиллярной колонке 21.03 мин, m/z 305 [М]+ (6.3); 232 [C12H13F3NO3]+ (44); 134 [C8H8NO]+ (100); 107 [C7H9N]+ (20.8).
Этиловый эфир 3,3,3-трифтор-2-метокси-2-(4-метиламино-фенил)-пропионовой кислоты (8b): Соединение было получено аналогично (8а). Выход соединения (8b) составил 1.35г, 75% из расчёта на две стадии. Светло-жёлтое масло, Rf=0.75.
Спектр ЯМР-1Н: CDCl3: 1.33 ppm: 3H-t, j= 10Hz, -Me; 2.84 ppm: 3H-s, -N-Me; 3.48 ppm: 3H-d, j=1 Hz, -O-Me; 4.36 ppm: 2H-d, j= 10 Hz, -CH2-; 6.57 ppm: 2H-d, j= 10 Hz, Aryl; 7.27 ppm: 2H-d, j= 10 Hz, Aryl.
Спектр ЯМР-19F: CDCl3: -72.1 ppm: s, -CF3.
Хромато-масс спектр: чистота ≥ 95%, время удержания вещества в капиллярной колонке 20.9 мин, 291 [М]+ (21.4); 260 [M-CH3O]+ (3.2); 218 [M-C3H5O2]+ (100); 134 [C8H8NO]+ (58.0).
Этиловый эфир 3,3,3-трифтор-2-(4-метиламино-фенил)-пропионовой кислоты (9): К полученному соединению (7) (0.0064моль) добавили 20 мл ледяной уксусной кислоты и 3г активированной цинковой пыли при интенсивном перемешивании, температуру поддерживали от 40-50 ° С в течение трёх часов. Контроль за прохождением реакции проводили методом ТСХ, элюент: хлороформ/этилацетат в соотношении 97/3, Rf=0.7. Затем, раствор уксусной кислоты был упарен, а оставшуюся массу перенесли в 50мл воды. рН водного раствора был доведён до 8 порционным прибавлением NaHCO3 и водный раствор был экстрагирован эфиром. Эфирный экстракт (3 раза по 50мл) был объединён, осушен безводным сульфатом натрия и упарен на роторном испарителе при пониженном давлении. Остаток был хроматографически очищен на 200мл SiO2, элюент: хлороформ/этилацетат в соотношении 95/5. Выход 1.3г, 78%. Светло-жёлтое масло.
Спектр ЯМР-1Н: CDCl3: 1.25 ppm: 3H-t, j= 10Hz, -Me; 2.83 ppm: 3H-s, N-Me; 4.16- 4.25 ppm: 2H-q, j=10 Hz, -CH2-, 1H-m, -CH*-; 6.57 ppm: 2H-d, j= 10 Hz, Aryl; 7.25 ppm: 2H-d, j= 10 Hz, Aryl.
Спектр ЯМР-19F: CDCl3: 9.45 ppm: d, j= 10 Hz, -CF3.
Хромато-масс спектр: чистота ≥ 97%, время удержания вещества в капиллярной колонке 19.01 мин, m/z 261 [М]+ (18.6); 188 [M-C3H5O2]+ (100); 138 [C8H9FN]+ (48.8).
3,3,3-Трифтор-2-(4-метиламино-фенил)-пропионовая кислота (10): Соединение было получено аналогично (4). Кристаллическое вещество светло-серого цвета, Тпл= 142-147 ° С с разложением. Выход 1.11г, 67% из расчёта на две стадии.
Спектр ЯМР-1Н:; 2.77 ppm: 3H-s, N-Me; 4.35 ppm: 1H-m, -CH*-; 6.77 ppm: 2H-d, j= 10 Hz, Aryl; 7.35 ppm: 2H-d, j= 10 Hz, Aryl.
Спектр ЯМР-19F: dmso-d6: 9.65 ppm: d, j= 10 Hz, -CF3.
Список литературы
- Тукей Г., Регуляторы роста растений в сельском хозяйстве, пер. с англ., М., 1958.
- Пат. РФ 2369094. Композиция для обработки семян, обладающая рост-регулирующим действием. Чкаников Н. Д., Свиридов В. Д., Кадыров А. А., Спиридонов Ю. Я.- ИНЭОС РАН, 2009, 2008127558/15.
- Муромцев Г.С., Чкаников Д.И., Кулаева О.Н., Гамбург К.З., Основы химической регуляции роста и продуктивности растений.: Агропромиздат, 1987, 383с.
- V.I. Dyachenko, A.S. Peregudov, N.D. Chkanikov., Journal of Fluorine Chemistry., v.128, N.7, p. 868-878, (2007).
Статья рекомендована к публикации членом редколлегии Д.х.н. Н.Д. Чканиковым
Fluorine Notes, 2014, 92, 3-4


