Поступило в редакцию: ноябрь 2013
УДК 547.539.151
Fluorine Notes, 2013, 91, 7-8
Препаративный метод получения полифторарилтриметилсиланов
В.Э. Бойкоa,b, A.A. Тютюновa,b, В.Л. Донa,b, С.М. Игумновa,b
a Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н.Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
b ЗАО НПО "ПиМ Инвест", 119334, Москва, Ленинский пр-т 47
e-mail: boykii@mail.ru
Аннотация. Разработаны два препаративных метода получения полифторарилтриметилсиланов из промышленно легкодоступных фторсодержащих ароматических кислот.
Ключевые слова: полифторарил(триметил)силаны, пентафторфенилтриметилсилан, тетрафторфенилдисиланы, тетрафторфенилсиланы.
Полифторарил(триметил)силаны являются универсальными реагентами для введения в органические молекулы фторароматических фрагментов. Соединения, содержащие данные фрагменты находят применение в электронике при создании диодов [1], жидкокристаллических дисплеев [2], в полиграфии [3] и т.д. Несмотря на широкую область применения данных соединений, способы получения таких промышленно востребованных соединений являются малопригодными для крупнотоннажного производства. В связи с этим целью нашего исследования стало разработать новый простой в технологическом отношении способ получения полифторарил(триметил)силанов, из доступных исходных веществ, выпускаемых промышленностью.
Синтетическая значимость фторорганосиланов привела к появлению целого ряда работ, посвященных разработке методов их получения. Так, синтез силана 3а был успешно осуществлен путем электрохимического силилирования пентафторбензола с использованием растворимых цинковых или алюминиевых анодов [10]. Фторарилсиланы образуются с хорошим выходом взаимодействием реактивов Гриньяра [4, 5] или их литиевых аналогов [6, 7] с триметилхлорсиланом ,альтернативой является реакция полифторарилгалогенидов с триметилхлорсиланом в присутствии трисдиалкиламидафосфинов [8]. Так же пентафторфенил(триметил)силан может быть получен реакцией пентафторбензоилхлорида с гексаметилдисиланом при катализе комплексом палладия PdCl2(PhCN)2 в присутствии триэтилфосфита [9].
Все вышеперечисленные способы получения силана 3а обладают существенными недостатками и не могут быть интерпретированы в производстве т.к. требуют использования легко воспламеняющихся растворителей, металлорганических соединений устойчивых только в инертной атмосфере [4-7], использования чрезвычайно токсичных, канцерогенных веществ [8], использования в значительных количествах дорогостоящих катализаторов [9], а так же сложного специального оборудования [10].
Нами предлагается использовать в качестве исходных синтонов промышленно легкодоступные фторсодержащие ароматические кислоты. Калиевые соли, которых взаимодействуя с триметилхлорсиланом в полярном апротонном растворителе, таком, как диметилформамид, диметилацетамид, N-метилпирролидон или сульфолан, при температуре 95–130°С с хорошим выходом образуют соответствующие полифторарил(триметил)силаны 3a-h.
В качестве типовой была выбрана реакция получения пентафторфенилтриметил силана 3a, в которой было изучено влияние растворителя и температуры.
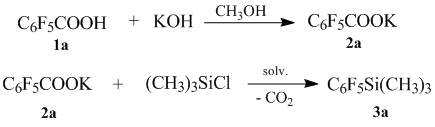
Полученные данные представлены в таблице № 1 исходя из которой видно что наилучшие результаты были получены при проведении процесса в ДМФА.
Таблица 1. Влияние природы растворителя.
|
# |
растворитель |
Т°С |
Выход % |
|
1 |
ДМФА |
95 |
86 |
|
2 |
ДМАА |
110 |
79 |
|
3 |
N-метилпирролидон |
105 |
81 |
|
4 |
сульфолан |
130 |
81 |
|
5 |
ацетонитрил |
80 |
0 |
Модельная реакция была распространена на другие фторсодержащие моно и дикарбоновые кислоты.
При этом из солей фторированных ароматических дикислот могут быть получены целевые продукты, содержащие как одну, так и две триметилсилильные группы в зависимости от количества взятого для реакции триметилхлорсилана. При использовании двукратного мольного избытка триметилхлорсилана по отношению к дикалиевой соле фторароматической дикислоты, получают тетрафторфенилдисиланы с выходом 73-80%.
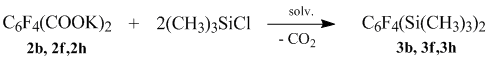
При эквимольном соотношении получают соответствующие тетрафторфенилсиланы полифторфенил(триметил)силаны идентичные полученным из соответствующих тетрафторфенилмонокарбоновых кислот с выходом 81-83%.
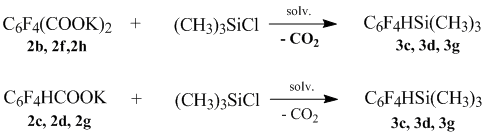
Полученные результаты представлены в таблице 2.
Таблица2. Получение фторарил(триметил)силанов из калиевых солей фторароматических кислот.
|
# опыта |
RfCOOH (1a-h) |
RfCOOK (2a-h) |
RfCOOK / ClSi(CH3)3 (мольн.) |
Solv. |
Выход RfSi(CH3)3 (3a-h) |
|
1 |
1a |
2a |
1 / 1 |
ДМФА |
(3a) 86 |
|
2 |
1b |
2b |
1 / 2 |
ДМФА |
(3b) 80 |
|
3 |
1c |
2c |
1 / 1 |
ДМФА |
(3c) 55 |
|
4 |
1b |
2b |
1 / 1 |
ДМФА |
(3d) 83 |
|
5 |
1d |
2d |
1 / 1 |
ДМФА |
(3d) 82 |
|
6 |
1e |
2e |
1 / 1 |
ДМФА |
(3e) 73 |
|
7 |
1f |
2f |
1 / 1 |
ДМФА |
(3c) 38 |
|
8 |
1g |
2g |
1 / 1 |
ДМФА |
(3g) 81 |
|
9 |
1h |
2h |
1 / 1 |
ДМФА |
(3g) 81 |
|
10 |
1h |
2h |
1 / 2 |
ДМФА |
(3h) 76 |
|
11 |
1f |
2f |
1 / 2 |
ДМФА |
(3f) 32 |
Возможны два механизма протекания данного процесса.
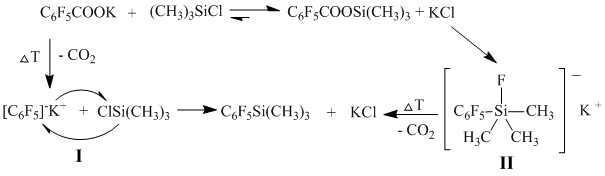
Для выяснения нами был разработан альтернативный способ получения фторсодержащих фенилтриметилсиланов из соответствующих триметилсилиловых эфиров фторсодержащих ароматических кислот в присутствии нуклеофила.
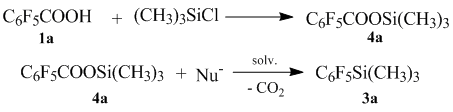
В случае же если проводить реакцию без катализатора (в отсутствии нуклеофила) то декарбоксилирования не происходит даже при более высоких температурах.
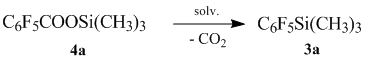
Для определения оптимальных условий проведения процесса, нами, на модельном примере получения пентафторфенилтриметилсилана, были протестированы различные растворители. Результаты приведены в таблице 3.
Таблица 3. Влияние природы растворителя.
|
# опыта |
Растворитель |
Выход RfSi(CH3)3, % |
|
1 |
ДМФА |
(3a) 89 |
|
2 |
ДМАА |
(3a) 80 |
|
3 |
сульфолан |
(3a) 95 |
|
4 |
N-метилпирролидон |
(3a) 88 |
Были получены хорошие результаты во всех тестируемых растворителях, но наилучшие показатели достигнуты в сульфолане в котором изучены влияние природы нуклеофила, а так же необходимого его количество для осуществления процесса.
Таблица 4. Влияние природы нуклеофила и его количества.
|
# опыта |
Nu- |
RfCOOSi(CH3)3 / Nu- |
Выход RfSi(CH3)3, % |
|
1 |
NaF |
1/1 |
(3a) 20% |
|
2 |
KF |
1/1 |
(3a) 95% |
|
3 |
KF |
1/0.1 |
(3a) 92% |
|
4 |
KF |
1/0.01 |
(3a) 89% |
|
5 |
CsF |
1/0.1 |
(3a) 93% |
|
6 |
KCl |
1/0.01 |
(3a) 91% |
Все нуклеофилы кроме фтористого натрия показали отличные результаты. Так же из полученных данных можно сделать вывод, что для полного прохождения реакции достаточно 1% нуклеофила. Таким образом было выяснено, что образование силана 3а происходит по механизму II через декарбоксилирование силилового эфира 4а. Попытка масштабирования в присутствии в качестве нуклеофила фтор-иона по завершении декарбоксилирования триметилсилилпентафторбензоата происходит дефтортриметилсилилирование с образованием пентафторфенильного полимера, что не наблюдается в случае использования хлор-иона в качестве нуклеофила.
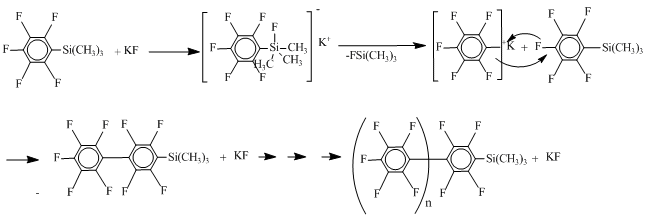
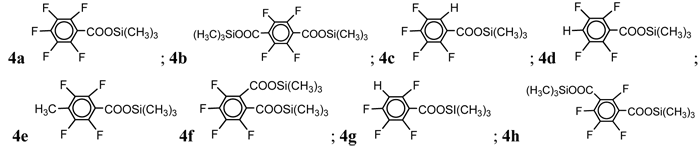
Результаты, полученные при исследовании модельной реакции, были распространены на другие фторсодержащие моно и дикарбоновые кислоты. Расчеты проводились с использованием ДМФА в качестве растворителя и хлористого калия в качестве нуклеофила. Полученные результаты представленны в таблице 5.
Таблица 5. Получение фторарил(триметил)силанов из фторсодержащих ароматических кислот, через образование соответствующих триметилсилиловых эфиров.
|
# опыта |
RfCOOH (1a-h) |
RfCOOH : ClSi(CH3)3 (моль) |
RfCOOSi(CH3)3 (4a-h) |
Выход RfSi(CH3)3 (3a-h), % |
|
1 |
1a |
1:3 |
4a |
(3a) 84 |
|
2 |
1b |
1:6 |
4b |
(3b) 83 |
|
3 |
1c |
1:3 |
4c |
(3c) 25 |
|
4 |
1b |
1:1 |
4d |
(3d) 83 |
|
5 |
1g |
1:3 |
4g |
(3g) 86 |
|
6 |
1d |
1:3 |
4d |
(3d) 83 |
|
7 |
1e |
1:3 |
4e |
(3e) 75 |
|
8 |
1h |
1:1 |
4g |
(3g) 79 |
|
9 |
1f |
1:1 |
4c |
(3c) 26 |
|
10 |
1h |
1:6 |
4h |
(3h) 81 |
|
11 |
1f |
1:6 |
4f |
(3f) 28 |
Экспериментальная часть
Общий метод синтеза фторсодержащих арилсиланов из соответствущих калиевых солей фторсодержащих карбоновых кислот
Гидроксид калия 23.7 г (0.42 моль) растворяют в 150 мл метанола и при перемешивании при комнатной температуре прибавляют раствор (0.42 моль) фторсодержащей бензойной кислоты 1 в 200 мл метанола, перемешивают 30 минут, выпавший осадок отфильтровывают и сушат на воздухе. Получают калиевую соль фторсодержащей бензойной кислоты 2.
Полученную калиевую соль фторсодержащей бензойной кислоты 2 (0.36 моль) при перемешивании прибавляют в 100 мл растворителя, затем добавляют 47.7 г (0.44 моль) триметилхлорсилана. После чего реакционную смесь нагревают до 70°С, выдерживают в течение 1 часа, затем температуру доводят до начала газовыделения и выдерживают при данной температуре до ее окончания, раствор охлаждают, выливают в воду, нижний слой отделяют, сушат сульфатом магния, фильтруют и перегоняют.
Общий метод синтеза фторсодержащих арилсиланов из соответствущих силиловых эфиров карбоновых кислот
К 150 г (1.38 моль) триметилхлорсилана добавляют при перемешивании (1,25 моль) фторсодержащей карбоновой кислоты 1 и нагревают до кипения, контролируя при этом скорость газовыделения. Затем отгонят избыток триметилхлорсилана и продукт перегонят в вакууме.
К полученному (триметил)силиловому эфиру фторсодержащейбензойной кислоты 4 (0,08 моль) добавляют при перемешивании 100 мл растворителя и 0,3 г (0,004 моль) хлористого калия, нагревают до начала газовыделения и перемешивают при этой температуре до его окончания, после чего раствор охлаждают до комнатной температуры и выливают в воду. Нижний слой отделяют, сушат над сульфатом магния, фильтруют, перегоняют.
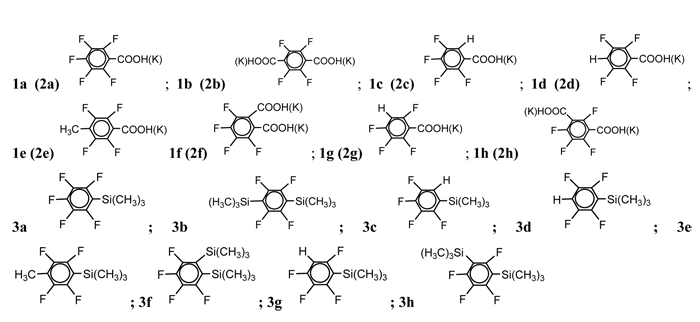
Спектральные данные силанов приведены в литературе: 3а [11], 3b [13], 3c [13], 3d [13,14,15], 3e 3f [11], 3g [12], 3h [12].
Триметил(2,3,5,6-тетрафтор-4-метилфенил)силан (3е).
Т.кип. 198 оС. Найдено (%): C, 50,79; H, 5,06; F, 32,27. C10H12F4Si. Вычислено (%): C, 50,85; H, 5,08; F, 32,20. ЯМР 1H δ: 0.55 (с, 9H, Si(CH3)3), 2.15 (с, 3H, CH3); ЯМР 19F δ: -128,5 (с, 2F 2,6), -140,2 (с, 2F 3,5) .
Список литературы
- V.A. Montes, G. Li, R. Pohl, J. Shinar, P. Anzenbacher Jr; Adv.Mater., 2004, 16, 2001;
- M. Matsui, K. Shirai, N. Tanaka, K. Funabiki, H. Muramatsu, K. Shibata, Y. Ohgomori, Y. Ohgomori, J. Mater. Chem., 1999, v.9, р. 2755
- S.L. Malhotra, патент США 1998, 5744273;
- M. Fild, O. Glemser, G. Christoph, Angewandte Chemie, 1964 76, p. 953;
- .C. Edmonson, A.E. Jukes, H. Gilman, Journal of Organometallic Chemistry, 1970, 25, 273-276;
- C. Tamborski, E.J. Soloski, Journal of Organometallic Chemistry, 1969, 17, 185-192;
- A.J. Oliver, W.A.G. Graham, Journal of Organoelemental Chem., 1969, 19, 17-27;
- V.V. Bardin, L.S. Pressman, L.N. Rogoza, G.G. Furin, J. Gen. Chem. USSR, 1992, 62, 2342-2349;
- А. Степанов, Электрохимия, 2000, 36, 210-218;
- Kashiwabara, M. Tanaka, Organometallics, 2006, 25, 4648-4652;
- X. Chen, V. Kumar, D.M. Lemal, S. Ramanathan, D. Sang; J. Org.Chem., 2012, 77, 2, 966-970;
- Kuroda, Ishikawa; Nippon Kagaku Zasshi; 1970, , 91, 489- 494;
- Tamborski, Soloski; J. Org.Chem., 1969, 17, 185-188;
- Bardin; Russian Chemical Bulletin., 1997, 46, 4, 780-785;
- M. Fujita, M. Obayashi, T. Hiyama; Tetrahedron, 1988, 44, 13, 4135-4146;
Статья представлена членом редколлегии С.М. Игумновым
Fluorine Notes, 2013, 91, 7-8


