Поступило в редакцию: ноябрь 2013
УДК 547.1; 547.15
Fluorine Notes, 2013, 91, 5-6
Препаративный метод получения высших фторалкилсиланов
В.Э. Бойкоa,b, A.A. Тютюновa,b, В.Л. Донa,b, С.М. Игумновa,b
a Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н.Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
b ЗАО НПО "ПиМ Инвест", 119334, Москва, Ленинский пр-т 47
e-mail: boykii@mail.ru
Аннотация. Разработан препаративный метод получения силанов Rf Si(CH3)3 с длиной Rf более С4, а так же впервые были получены силаны из метил 2-(2-бром-1,1,2,2-тетрафторэтокси)-2,3,3,3-тетрафторпропионата (n=1) и его олигомера (n=2).
Ключевые слова: фторалкилсиланы, перфторгексил(триметил)силан, перфтороктил-(триметил)силан, метил 2,3,3,3-тетрафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)этокси)пропионат.
Фторсодержащие алкилсиланы являются уникальными реагентами для введения фторалкильной группировки в различные классы органических и элементоорганических соединений [1-3]. По своему химическому поведению они подобны реактивам Гриньяра, и в то же время работать с ними удобно, так как они в отличие от реактивов Гриньяра могут длительное время храниться без разложения, кроме того фторированные алкилсиланы менее чувствительны к наличию в молекуле субстрата различных функциональных групп.
С тех пор как Рупертом в 1984 году впервые был получен трифторметил(триметил)силан, названный впоследствии реактивом Руперта, реакцией триметилиодида с триметилхлорсиланом в присутствии трис(диэтиламино)фосфина [4], и было исследовано его трифторметилирующее действие в условиях нуклеофильного катализа, появилось значительное число исследований, посвященных методам получения самого реактива Руперта и и других фторированных силанов. [1, 5-9].
Трифторметил(триметил)силан, а также бром- и хлордифторметил- и пентафторэтил(триметил)силаны получают взаимодействием фторалкилгалогенидов с триметилхлорсиланом в присутствии металлических Al , Mg или Li. [10-15]. Также силаны с длиной цепи С1-С4 были получены взаимодействием перфторгалогенидов в диглиме с триметилхлорсиланом и тетракис(диметиламино)этиленом [16] с выходами 55-81%., есть сведения о получении таким же методом и перфторгексил(триметил)силана, выход составляет предположительно от 40% [17].
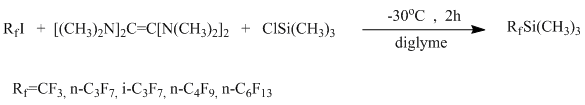
Кроме этого известно незначительное число примеров получения перфторалкилсиланов с длиной цепи >4.
Так перфторгексил(триметил)силан был получен взаимодействием перфторгексилиодида с триметилхлорсиланом в присутствии иодида самария с 68% выходом [18].
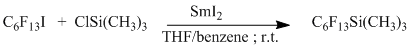
Описано получение перфтороктил(триметил)силана взаимодействием перфтороктилмагнийиодида или бромида с триметилхлорсиланом в ТГФе с выходами от 33 до 77% [19-22].
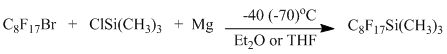
Нами ранее был предложен метод синтеза перфторалкилсиланов взаимодействием перфторалкилгалогенидов с силилирующими агентами (Me3SiOC(O)CF3, Me3SiOSO2Me), в присутствии цинк-медной пары в условиях реакции Барбье [23].
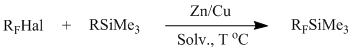
R = Cl, CF3CO2; CH3SO3
RF = CF3;
C2F5; nC3F7; iC3F7;
C4F9; CF2CO2Me; CF2CO2Et; CF2CF2OCF=CF2.
Таким образом нами были получены различные триметилсиланы, в том числе перфторалкил и перфторалкенилсиланы, однако все полученные нами перфторалкил(триметил)силаны имели длину углеродной цепи до С4 [21]. Эти силаны после их образования отслаиваются от реакционной смеси верхним слоем, таким образом выводятся из взаимодействия. При попытке получить силаны с большей длиной Rf , чем С4, мы наблюдали в спектрах 19F ЯМР сигналы в области, характерной для Rf H, сигналы же в области характерной для Rf Si, наблюдались лишь на уровне шумов, что заставило нас тогда ошибочно предположить , что получить таким способом силаны с большей длиной Rf , чем С4, невозможно.
Однако в ходе дальнейших исследований мы обнаружили, что чем больше времени проходит от момента окончания процесса до завершения отделения силана от реакционной смеси, тем больше содержание перфторалкилгидридов (RfH). Первоначальные данные спектроскопии 19F ЯМР можно объяснить тем, что с момента отбора пробы до момента снятия спектра проходило достаточно времени для протодесилилирования образовавшегося продукта. Этого можно избежать, обработав реакционную смесь раствором соляной или серной кислоты сразу же после проведения процесса.
Таким образом из соответствующих бромидов (1а) и (1b) нами были получены перфторгексил(триметил)силан (2a) и перфтороктил(триметил)силан (2b) с выходами 89 и 77% соответственно.
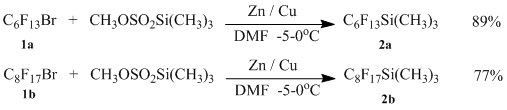
Подобным образом нами также были получены силаны (4а) и (4b) из метил 2-(2-бром-1,1,2,2-тетрафторэтокси)-2,3,3,3-тетрафторпропионата (n=1) (3а) и его олигомера (n=2) (3b).
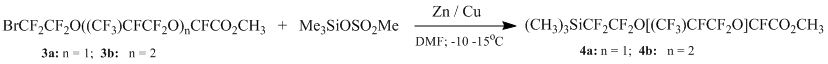
Эта реакция представляет особый интерес ввиду возможности деалкоксилирования эфиров (3а) и (3b) в присутствии цинка.
Подводя итоги сказанному, нами разработан препаративный метод получения силанов с длиной Rf более С4, а так же впервые были получены силаны из метил 2-(2-бром-1,1,2,2-тетрафторэтокси)-2,3,3,3-тетрафторпропионата (3а) (n=1) и метил 2,3,3,3-тетрафтор-2-(1,1,2,3,3,3-гексафтор-2-(1,1,2,2-тетрафтор-2-этокси)пропокси)пропионата (3b).
Экспериментальная часть
ЯМР 19F спектры записаны на спектрометре “Bruker AM300” при 282 MHz, внешний стандарт CDCl3 или D2O. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. 1H в м.д. относительно ТМС. Спектральные данные для силанов (2а) и (2b) приведены в литературе (24,20) .
Триметил(перфторгексил)силан (2a)
В трехгорлой колбе объемом 250 мл к 100 мл ДМФА при перемешивании добавляют 13 г цинка, 0,5 г CuCl и 1 г триметилхлорсилана, выдерживают 30 мин, затем реакционную смесь охлаждают до 0°С и по каплям добавляют 20.2 г триметисилилового эфира метансульфокислоты,, охлаждают до -5°С и по каплям добавляют 40 г перфторгексилбромида. Далее выдерживают еще час при -5°С и затем выливают в перемешиваемую смесь H2SO4 со льдом 20% концентрации. Нижний слой отделяют, сушат сульфатом магния, фильтруют и перегоняют. Получают 35 г перфторгексилтирметилсилана в виде бесцветной жидкости. Ткип = 147°С. Выход 89%.
Спектр ЯМР 19F :-83,26(т,3F,CF3), -120,44(c,2F), -123,50(c,2F, CF2),-124,51 (c,2F, CF2),-128,06(c,2F ,CF2),-130,05 (c, 2F, CF2Si); 1H ЯМР:0,5 (c,9H,).
Триметил(перфтороктил)силан (2b)
В трехгорлой колбе объемом 250 мл к 100мл ДМФА при перемешивании добавляют 10,5 г цинка, 0,4 г CuCl и 1 г триметилхлорсилана, выдерживают 30 мин, охлаждают до 0°С и по каплям добавляют 16,2 г триметисилилового эфира метансульфокислоты, затем реакционную смесь охлаждают до -5°С и по каплям добавляют 40 г перфтороктилбромида. Далее выдерживают еще час при -5°С и затем выливают в перемешиваемую смесь H2SO4 со льдом 20% концентрации. Нижний слой отделяют. Его перегоняют с водяным паром, сушат сульфатом магния, фильтруют и перегоняют в вакууме. Получают 30 г перфторгексил(тирметил)силана в виде бесцветной жидкости.
Ткип = 75°С/20мм.рт.ст. Выход 77%. Спектр ЯМР 19F : -82,76 (т.,3F,CF3),
-129,67(c.2F,CF2Si),-127,67(c.2F,CF3CF2),-123,09(м.,8F,(CF2)4)),
-120( м.,2F,CF2CF2Si),
1H ЯМР:0,7(c,9H,Si(CH3)3)).
Метил 2,3,3,3-тетрафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)этокси)пропионат (4а).
В трехгорлой колбе объемом 250 мл к 150 мл ДМФА при перемешивании добавляют 11 г цинка, 0,5 г CuCl и 1 г триметилхлорсилана, выдерживают 30 мин, затем реакционную смесь охлаждают до 0°С и по каплям добавляют 17 г триметисилилового эфира метансульфокислоты, охлаждают до -10 (-15)°С и по каплям добавляют 30 г метил 2-(2-бром-1,1,2,2-тетрафторэтокси)-2,3,3,3-тетрафторпропионата. Далее выдерживают еще час при -10 (-15)°С и затем выливают в перемешиваемую смесь H2SO4 со льдом 20% концентрации. Нижний слой отделяют, сушат сульфатом магния, фильтруют и перегоняют в вакууме. Получают 15 г метил 2,3,3,3-тетрафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)этокси)пропионата в виде бесцветной жидкости. Выход 51%.
Ткип = 34°С /20мм.рт.ст
| Спектр ЯМР 19F | : |
-83,89 (д.,3F,CF43), от -81,64 до -90,19 (м,2F,CF22O), -132,23(c,2F,CF12Si),-132,99(д,1F,CF3);
1H ЯМР:0,5 (c,9H,Si(CH3)3)),4,2(c,3H,OCH3).
Метил 2,3,3,3-тетрафтор-2-(1,1,2,3,3,3-гексафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)-этокси)пропокси)пропионат (4b)
В трехгорлой колбе объемом 250 мл к150 мл ДМФА при перемешивании добавляют 13 г цинка, 0,5 г CuCl и 1,1 г триметилхлорсилана, выдерживают 30 мин, затем реакционную смесь охлаждают до 0°С и по каплям добавляют 20 г триметисилилового эфира метансульфокислоты, охлаждают до -10 (-15)оС и по каплям добавляют 52 г метил 2,3,3,3-тетрафтор-2-(1,1,2,3,3,3-гексафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)этокси)-пропокси)пропионата. Далее выдерживают еще час при -10 (-15)°С и затем выливают в перемешиваемую смесь H2SO4 со льдом 20% концентрации. Нижний слой отделяют, сушат сульфатом магния, фильтруют и перегоняют в вакууме. Получают 36 г метил 2,3,3,3-тетрафтор-2-(1,1,2,3,3,3-гексафтор-2-(1,1,2,2-тетрафтор-2-(триметилсилил)этокси)-пропокси)пропионата в виде бесцветной жидкости. Выход 71%. Ткип = 52°С / 5мм.рт.ст.
| Спектр ЯМР 19F | 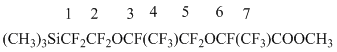 |
: |
-82,03(д.,3F,CF63), -84,49(т.,3F,CF43), от -80,13 до -87,45 (м. 4F,CF2,52O), -131,97(м.,2F,CF12Si),-133,39, -147,20 (м..2F,CF3+7), 1H ЯМР:0,4 (c.9H,Si(CH3)3)),4,1(c.3H,OCH3).
Список литературы
- G.K.S. Prakash, A.K. Yudin, Chem.Rev., 1997, 97, 757-786.
- J.-A. Ma, D. Cahard, Chem.Rev., 2004, 104, 6119-6146 (2008, 108, PR1-PR43).
- K. Uneyama, J.Fluor.Chem., 2008, 129, 550-576.
- I. Ruppert, K. Schlich, W. Volbach, Tetrahed.Lett., 1984, 25, 2195-2198.
- R.P. Singh, J.M. Shreeve, Tetrahedron, 2000, 56, 7613-7632.
- S. Roy, B.T. Gregg, G.W. Gribble, V.-D. Le, S. Roy, Tetrahedron, 2011, 67, 2161-2195.
- A.D. Dilman, V.V. Levin, Eur.J.Org.Chem., 2011, 831-841.
- O.A. Tomashenko, V.V. Grushin, Chem.Rev., 2011, 111, 4475-4521.
- E.J. Cho, S.L. Buchwald, Org.Lett., 2011, 13, 6552-6555.
- J. Grobe, J. Hegge, ZAAC, 2008, 634, 1975-1990.
- J. Grobe, J. Hegge. Synlett, 1995, 641-642.
- K.I. Petko, S.Y. Kot, L.M. Yagupolskii, J.Fluor.Chem., 2008, 129, 301-306.
- S.M. Igoumnov, V.A. Vyazkov, A.V. Prokhorov, RF Patent № 2399624, 2009.
- S.M. Igoumnov, E.V. Igoumnova. Sintezy ftororganicheskikh soedinenii (Syntheses of Organofluorine Compounds), Part 1, 2nd ed., ZAO NPO P&M-Invest, Moscow, 2010.
- S. Utsumi, T. Katagiri, K. Uneyama, Tetrahedron, 2012, 68, 580-583.
- V.A. Petrov, Tetrahedron Letters , 2001 v.42, , 3267-3269.
- Murphy-Jolly, B. Makeba, Lewis, L. Lesley, Caffyn, J.M. Andrew, Chemical Communication (Cambridge, U.K.), 2005, 35, 4479-4480
- M. Yoshida, D. Suzuki, M Iyoda, J. Chem. Soc., Perkin Trans. 1, 1997, 5, 643-648.
- E.I. Du Pont de Nemours and Co., US Patent № 5093512 1992.
- C.F. Smith, E.J. Soloski, C. Tamborski, J.Fluor.Chem., 1974, 4, 35-45.
- L.G. Vaughan, W.A. Sheppard, J. American Chem. Soc., 1969, 91, 6151-6156.
- G.J.Chen, L.S.Chen, K.S.Eapen, W.E.Ward, J.Fluor.Chem., 1974, 69, 61-66.
- S.M. Igoumnov, V.K. Men'shikov, V.E. Boyko, A.A. Tyutyunov, S.R. Sterlin //Fluorine notes: сетевой журн., 2012, 6(85), URL: /public/2012/6_2012/letters/letter4.html (дата обращения: 11.12.2013).
- Nagaki, Aiichiro; Tokuoka, Shinya; Yamada, Shigeyuki; Tomida, Yutaka; Oshiro, Kojun; et al., Organic and Biomolecular Chemistry, 2011 , vol. 9, p. 7559 – 7563.
Статья представлена членом редколлегии С.М. Игумновым
Fluorine Notes, 2013, 91, 5-6


