Поступило в редакцию: ноябрь 2013
УДК 547.512; 547.642; 547.665;543.422.25, 632.951.2
Fluorine Notes, 2013, 91, 3-4
Синтез и биологическая активность аналогов перметрина, содержащих в спиртовом фрагменте 4-метокси-2,3,5,6-тетрафторбензильную группу
О.И.Лукашов1, Н.А.Соколова1, С.Н.Голосов1, Н.Е.Кузьмина2, П.В.Казаков1, Н.С.Мирзабекова1
1) Государственный научно-исследовательский институт органической хи-мии и технологии.
111024, Москва, шоссе Энтузиастов, 23,
e-mail: dir@gosniiokht.ru
2) Федеральное государственное бюджетное учреждение "Научный центр экспертизы средств медицинского применения" Министерство здраво-охранения российской федерации (ФГБУ "НЦЭСМП" Минздрава России). 127051, Москва, Петровский бульвар д. 8
Аннотация. Синтезирован ряд аналогов перметрина, содержащих в качестве спиртового компонента 4-метокси-2,3,5,6-тетрафторбензильный фрагмент, а во втором положении циклопропанового кольца : СН3, С2Н5, С3Н7, С6Н5СН2, (СН2)п (n = 4,5). Определена инсектицидная активность новых соединений на комнатных мухах, жуках рисового долгоносика и бобовой тле.
Ключевые слова:перметрин, тетрафторбензильный фрагмент, инсектицидная активность
Пиретроиды являются аналогами природных веществ пиретринов – сложных эфиров циклопропанкарбоновой кислоты, обладающих инсектицидной активностью. Исследования в области пиретроидов продолжаются, включая синтез новых соединений [1-4]. Традиционным направлением синтеза новых пиретроидов является варьирование сложноэфирной группы. В последнее время в литературе появились данные, свидетельствующие о высокой инсектицидной активности аналогов хризантемовой и перметриновой кислот, содержащих в спиртовом фрагменте 4-метокси-2,3,5,6-тетрафторбензильную группу [5-9].
Cледует отметить, что описаны способы получения биологически активных пиретроидных структур иным путем – заменой гем-диметильной группировки во втором положении циклопропанового кольца на различные функциональные заместители [9-14]. Ранее нами было показано, что аналоги этиловых и 3-феноксибензиловых эфиров перметриновой кислоты, содержащие алкильные и фенилалкильные заместители во втором положении циклопропанового кольца обладают слабой инсектицидной активностью, но при этом проявляют не типичную для пиретроидов явно выраженную ювеноидную активность [15,16]. Мы предположили, что введение фторбензильной группы в спиртовую часть молекулы новых пиретроидных соединений позволит значительно повысить их инсектицидную активность.
Целью данной работы является синтез и изучение биологической активности производных 4-метокси-2,3,5,6-тетрафторбензилового эфира перметриновой кислоты, содержащих во втором положении циклопропанового кольца различные заместители алкильного, фенилалкильного ряда, а так же спиро-производные.
4-Метокси-2,3,5,6-тетрафторбензилциклопропанкарбоксилаты (II) были получены путем взаимодействия 4-метокси-2,3,5,6-тетрафторбензилбромида с натриевой солью соответствующего эфира 2,2-дизамещенной перметриновой кислоты (I) [15] при нагревании реакционной массы в течении 8 – 10 часов при 100°С по следующей схеме:
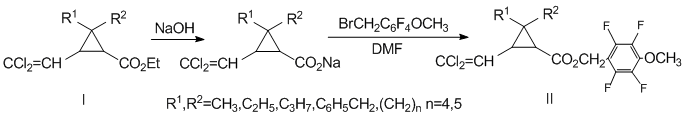
В индивидуальном виде вещества выделяли колоночной хроматографией. Полученные соединения (IIа-ж) представляют собой маслообразные вещества светло-желтого цвета, нерастворимые в воде и легко растворимые в обычных органических растворителях. Строение новых соединений подтверждено данными ИК, ЯМР-спектроскопии (1H, 13C, 1Н-1Н COSY (Correlation Spectroscopy) [16], 1Н-13С HSQC (Heteronuclear Single QuantumCorrelation) [17], хромато-масс-спектрометрии, а также элементным анализом.
Пространственная конфигурация 4-метокси-2,3,5,6-тетрафтор-бензилциклопропанкарбоксилатов 2,2-дизамещенной перметриновой кислоты определена с помощью двумерного ЯМР-эксперимента ROESY (Rotating-frame Overhauser Effect Spectroscopy) [18], данные представлены в экспериментальной части.
Исследование биологической активности [20] показало, что полученные соединения обладают слабой инсектицидной активностью по отношению к модельным насекомым, в концентрации 0,1% проявляют близкую по своим величинам инсектицидную активность. Полученные нами, для сравнения, 4-метокси-2,3,5,6-тетрафторбензильные производные хризантемовой и перметриновой кислот (IIа и IIб) проявили высокую инсектицидную активность (СК50), превышающую эталоны тетраметрин и перметрин для комнатных мух в 5 и 9 раз, соответственно.
Из данных биологической активности можно сделать вывод о том, что использование фторбензильной группы в спиртовой части молекулы аналогов перметриновой кислоты, имеющих различные группировки во втором положении циклопропанового участка, не повышают их инсектицидную активность. По-видимому, наличие диметильной группы во втором положении циклопропанового кольца является определяющим для проявления пиретроидом его инсектицидной активности. Однако в современной литературе отсутствуют достоверные сведения о роли диметильной группировки: несет ли эта группа чисто структурные функции или участвует в формировании рецепторного участка.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР регистрировали на спектрометре Bruker AVANCE 300 с рабочей частотой 300 МГц в CDCl3 при комнатной температуре, внутренний стандарт – ТМС. ИК спектры получены на спектрометре Perkin-Elmer 1720 в CCl4 или в тонкой пленке. Хромато-масс-спектры записаны на приборе FISONS TRIO 1000 с квадрупольным масс-анализатором. Метод ионизации – электронный удар. ВЭЖХ анализ выполняли на жидкостном хроматографе «Миллихром АО-2». Детектор спектрофотометрический, используемые колонки обращенно-фазовые. Колоночную хроматографию проводили на Silica gel 60 (0,040-0,063mm) фирмы Merck с использованием стеклянных колонок с внутренним диаметром 48 мм и длиной 300 мм фирмы KONTES, элюенты — гексан – бензол (1:1), бензол – диэтиловый эфир (9:1). Проверку чистоты и индивидуальности соединений и контроль за ходом реакции осуществляли на пластинах Silica gel 60 F254 Merck.
4-Метокси-2,3,5,6-тетрафторбензилбромид, ДМФА – коммерческие препараты. Этиловый спирт абсолютировали по методике [21].
Общая методика. Раствор 0.1 ммоль этилового эфира 2,2-дизамещенной перметриновой кислоты (I), 0,11 ммоль гидроксида натрия в 200 мл этилового спирта кипятили 3ч. Спирт отгоняли при пониженном давлении, твердый остаток растворяли в 150 мл ДМФА. К полученному раствору добавляли 0,11 ммоль 4-метокси-2,3,5,6-тетрафторбензилбромида и нагревали при 100°С 8ч. ДМФА удаляли в вакууме роторного испарителя, к остатку добавляли 150 мл бензола и промывали водой (3´100 мл). Бензол отгоняли в вакууме на роторном испарителе Остаток – маслообразный продукт светложелтого цвета – хроматографировали на препаративной колонке, элюент – гексан-бензол. Содержание основного вещества определяли методом ВЭЖХ.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 2,2-диметил-3-(2-метил-1-пропенил)-циклопропанкарбоновой кислоты (IIа). Выход 83%, выход после разделения на колонке 61%, содержание основного вещества 96%. ИК-спектр, ν, см-1:1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H δ, м.д., изомер 1R*3R*: 1.16 c (3H, СН3), 1.21 c (3Н, СН3), 1.61 д (1Н, CН), 1.63 с (3H, СН3), 1.66 с (3H, СН3) 1.87 т (1H, CН), 4.05 с (3Н, ОСН3), 5.12 д (2Н, ОСН2), 5.33 д (1Н, CH=); изомер 1R*3S*: 1.09 c (3H, СН3), 1.23 c (3H, СН3), 1.35 д (1Н, CН), 1.66 с (3H, СН3), 1.70 с (3H, СН3), 2.04 т (1H, CН), 4.05 с (3H, ОСН3), 4.85 д (1Н, CH=), 5.12 д (2Н, ОСН2). 13С, δ, м.д., изомер 1R*3R*: 14.50, 17.97, 26.55, 28.40, 28.87, 30.72, 32.43, 52.63, 61.73 т (4J 4.2 Гц), 107.83 т (2J 17.4 Гц), 117.77, 134.91, 138.85 т (2J4.2 Гц), 139.60 д (1J 248.6 Гц), 142.30 д (1J 248.6 Гц), 144.23 д (1J 248.6 Гц), 147.42 д (1J 248.6 Гц), 170.14, изомер 1R*3S* 18.14, 20.08, 21.81, 25.21, 28.86, 33.01, 34.25, 53.05, 61.78 т (4J 4.2 Гц), 107.83 т (2J 17.4 Гц), 120.79, 135.61, 138.85 т (2J 4.2 Гц), 141.0, д (1J 248.6 Гц), 145.90 д (1J 248.6 Гц), 170.01. Масс-спектр, м/z: [М]+360. Найдено, %: C 59.75; H 5.39; F 21.49. C18H20F4O3. C18H20F4O3. Вычислено, %: C 60.00; H 5.59; F 21.09. М 360.35.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоновойксилоты (IIб). Выход 81%, выход после разделения на колонке 57%, содержание основного вещества 96%.. ИК-спектр, ν, см-1: 1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H, δ, м.д., изомер 1R*3R*: 1.19 с (3Н, СН3), 1,30 с (3Н, СН3), 1.85 д (1Н, СН), 2.05 к (1Н, СН), 4.09 с (3Н, ОСН3), 5.20 с (2Н, ОСН2), 6.26 д (1Н, СН=). изомер 1R*3S*: 1.23 с (3Н, СН3), 1.36 с (3Н, СН3), 1.67 д (1Н, СН), 2.33 д.д (1Н, СН), 4.13 с (3Н, ОСН3), 5.25 с (2Н, ОСН2), 5.65 д (1Н, СН=). Спектр ЯМР 13С, δ, м.д., изомер 1R*3R*: 15.37, 22.60, 27.71, 30.68, 31.36, 53.84, 62.07 т (4J 4.2 Гц), 107.41 т (2J 17.4 Гц), 120.85, 124.61, 139.01 т (2J 4.2 Гц), 140.81 д (1J 248.6 Гц), 145.94 д (1J 248.6 Гц), 170.71; изомер 1R*3S*: 19.99, 22.46, 29.35, 33.20, 34.36, 53.66, 62.08 т (4J 4.2 Гц), 107.41 т (2J 17.5 Гц), 122.27, 126.82, 139.01 т (2J 4.8 Гц), 140.81 д (1J 246.8 Гц), 145.77 д (1J 248.6 Гц), 170.31. Масс-спектр, м/z: [М]+401. Найдено, %: C 47.78; H 3.32; F 19.11; Cl 17.82. C16H14F4Cl2O3. Вычислено, %: C 47.90; H 3.52; F 18.94; Cl 17.67. М 401.19.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 2-метил-3-(2,2-дихлорэтинил)-2-этилциклопропанкарбоновой кислотыксилат (IIв). Выход 76%, выход после разделения на колонке 52%, содержание основного вещества 98%.. ИК-спектр, ν, см-1:1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H, δ, м.д., изомер 1R*2R*3S*: 0.89 т, (3Н, СН3), 1.23 с (3Н, СН3), 1.36 м (2Н, CН2), 1.67 д (1H, CН), 2.33 д.д (1Н, СН), 4.13 с (3Н, ОСН3), 5.25 с (2Н, ОCН2), 5.65 д (1H, СН=); изомер 1R*2R*3R*: 1.01 c (3Н, СН3), 1.19 с (3Н, СН3), 1.30 м (2Н, CН2), 1.85 д (1H, CН), 2.05 к (1Н, СН), 4.09 с (3Н, ОСН3), 5.20 с (2Н, ОCН2), 6.26 д (1H, СН=). Спектр ЯМР 13С, δ, м.д., изомер 1R*2R*3S*: 14.46, 19.99, 22.46, 29.35, 33.20, 34.36, 53.66, 62.08 т (4J 4.2 Гц), 107.41 т (4J 17.4 Гц), 122.27, 126.82, 139.0 т (4J 4.2 Гц), 140.8 д (1J 248.6 Гц), 145.77 д (1J 248.6 Гц), 170.3; изомер 1R*2R*3R*: 13.96, 15.37, 22.60, 27.71, 30.68, 31.36, 53.84, 62.07 т (4J 4.2 Гц), 107.41 т (4J 17.4 Гц), 120.85, 124.61, 139.0 т (4J 4.2 Гц), 140.8 д (1J 248.6 Гц), 145.94 д (1J 248.6 Гц), 170.7. Масс-спектр, м/z: [М]+415. Найдено, %: C 49.05; H 3.64; F 18.57; Cl 17.34. C17H16F4CL2O3. Вычислено, %: C 49.18; H 3.88; F 18.30; Cl 17.08. М 415.21.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 2-пропил-3-(2,2-дихлорэтинил)-2-этилциклопропанкарбоновой кислоты (IIг). Выход 80%, выход после разделения на колонке 56%, содержание основного вещества 97%. ИК-спектр, ν, см-1: 1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H, δ, м.д., изомер 1R*2R*3S*: 0.84 т (3Н, СН3), 0.87 т (3Н, СН3), 1.20 (1H, СН2), 1.36 м (2Н, СН2), 1.49 (1H, СН2), 1.66 м (2Н, СН2), 1.79 д (1Н, СН), 2.03 д.д (1Н, СН), 4.10 с (3н, ОСН3), 5.15 с (2H, ОCН2), 6.30 д (1Н, СН=); изомер 1R*2S*3S*: 0.84 т, (3Н, СН3), 0.87 т (3Н, СН3), 1.24 (1H, СН2), 1.36 м (2Н, СН2), 1.60 (1H, СН2), 1.60 м (2Н, СН2), 1.79 д (1Н, СН), 2.03 д.д (1Н, СН), 4,08 с (СН, ОСН3), 5.20 с (2H, ОCН2), 6.38 д (1Н, СН=). Спектр ЯМР 13С, δ, м.д., изомер 1R*2R*3S*: 10.20, 13.99, 17.56, 19.24, 30.64, 32.14, 36.97, 39.78, 53.40, 62.06 т (4J 4.2 Гц), 107.69 т (2J 17.4 Гц), 120.72, 124.38, 139.0 т (2J 4.2 Гц), 140.72 д (1J 248.6 Гц), 145.86 д (1J 248.6 Гц), 170.0; изомер1R*2S*3S*: 10.22, 13.99, 19.11, 26.11, 30.77, 31.07, 32.57, 36.76, 53.84, 62.06 т (4J 4.2 Гц), 107.69 т (2J 17.4 Гц), 120.66, 124.49, 139.0 т (4J 4.2 Гц), 140.72 д (1J 248.6 Гц), 145.86 д (1J 248.6 Гц), 170.0. Масс-спектр, м/z: [М]+429. Найдено, %: C 50.17; H 3.84; F 17.96; Cl 16.73. C18H18F4CL2O3. Вычислено, %: C 50.37; H 4.23; F 17.70; Cl 16.52. М 429.24.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 2-бензил-2-метил-3-(2,2-дихлорэтинил)циклопропанкарбоновой кислоты (IIд). Выход 75%, выход после разделения на колонке 52%, содержание основного вещества 97%. ИК-спектр, ν, см-1: 1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H, δ, м.д., изомер 1R*2R*3R*: 1.22 с (3Н, СН3), 2.04 д (1Н, СН), 2.28 т (1Н, СН), 2.73 д (1H, СН2), 2.82 д (1H, СН2), 4.10 с (3Н, ОСН3), 5.20 с (2Н, ОСН2), 6.34 д (1Н, СН=), 7.20 д (2Н, С6Н5), 7.27 м (1Н, С6Н5), 7.32 м (2Н, С6Н5); изомер1R*2R*3S*: 1.21 с (3Н, СН3), 1.98 д (1Н, СН), 2.40 д-д (1Н, СН), 2.73 д (1H, СН2), 2.82 д (1H, СН2), 4.12 с (3Н, ОСН3), 5.20 с (2Н, ОСН2), 5.79 д (1Н, СН=), 7.20 д (2Н, С6Н5), 7.27 м (1Н, С6Н5), 7.32 м (2Н, С6Н5). Спектр ЯМР 13С, δ, м.д., изомер 1R*2R*3R*: 12.91, 29.86, 30.95, 32.08, 46.86, 53.52, 62.07 т (4J 4.2 Гц), 107.41 т (2J 17.4 Гц), 121.35, 124.29, 126.8, 128.4, 129.3, 137.6, 139.01 т (2J 4.2 Гц), 140.8 д (1J 248.6 Гц), 145.94 д (1J 248.6 Гц), 169.8; изомер 1R*2R*3S*: 17.33, 31.71, 32.49, 34.06, 41.79, 53.84, 62.07 т (4J 4.2 Гц), 107.41 т (2J 17.4 Гц), 122.61, 124.64, 126.7, 128.5, 128.9, 138.1, 139.0 т (2J 4.2 Гц), 140.8 д (1J 248.6 Гц), 145.94 д (1J 248.6 Гц), 170.1. Масс-спектр, м/z: [М]+477. Найдено, %: C 55.15; H 3.51; F 16.23; Cl 16.03. C22H18F4CL2O3. Вычислено, %: C 55.36; H 3.80; F 15.92; Cl 14.86. М 477.29.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 3-(2,2-дихлорэтинил)-спиро[2.5]октановой кислоты-(IIе). Выход 77%, выход после разделения на колонке 55%, содержание основного вещества 96%. ИК-спектр, ν, см-1: 1735 (С=О эфирн.), 1620 (С=С). Спектр ЯМР 1H, δ, м.д.: 1.36 м (2Н, С6Н10), 1.47 м (1Н, С6Н10), 1.48 м (2Н, С6Н10), 1.53 м (2Н, С6Н10), 1.60 м (2Н, С6Н10), 1.63 м (1Н, С6Н10), 1.69 м (1H, СН), 2.24 д.д (1Н, СН), 4.08 с (3Н, ОСН3), 5.17 с (2Н, ОСН2). 5.59 д (СН=). Спектр ЯМР 13С, δ, м.д.: 25.36, 25.50, 25.97, 29.93, 32.53, 32.60, 33.04, 36.86, 53.66, 62.04 т (2J 4.2 Гц), 121.87, 126.49, 107.45 т (2J 17.4 Гц), 139.1 т (2J 4.2 Гц), 140.7 (1J 248.6 Гц), 145.84 (1J 248.6 Гц), 170.35. Масс-спектр, м/z: [М]+441. Найдено, %: C 51.49, H 3.93; F 17.44; Cl 16.17. C19H18F4CL2O3. Вычислено, %: C 51.72; H 4.11; F 17.22; Cl 16.07. М 441.25.
4-Метокси-2,3,5,6-тетрафторбензиловый эфир 3-(2,2-дихлорэтинил)-спиро[2.4]гептановой кислоты (IIж). Выход 79%, выход после разделения на колонке 58%, содержание основного вещества 96%. ИК-спектр, ν, см-1:1735 (С=О эфирн.), 1620 (С=С ). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.57 м (4Н, С5Н8), 1.59 д (1H, СН), 1.63 м (4Н, С5Н8), 2.32 д-д (1H, СН), 4.03 с (3Н, ОСН3), 5.11 с (2Н, ОСН2), 5.43 д (1Н, СН=). Спектр ЯМР 13С (CDCl3), δ, м.д., 25.74, 25.90, 31.72, 32.42, 32.63, 34.33, 39.51, 53.56, 62.04 т (2J 4.2 Гц), 107.63 т (2J 17.4 Гц), 121.51, 127.50, 139.1 т (2J 4.2 Гц), 140.7 д (1J 248.6 Гц), 145.84 д (1J 248.6 Гц), 170.67. Масс-спектр, м/z: [М]+427. Найдено, %: C 50.23; H 3.43; F 18.32; Cl 16.27. C18H16F4CL2O3. Вычислено, %: C 50.61; H 3.77; F 17.79; Cl 16.60. М 427.23.
Оценка инсектицидной активности
Опыты проводили (скрининговые испытания в отсекающей концентрации 0.1 %) в лабораторных условиях на стандартных чувствительных лабораторных расах комнатных мух Musca domestica L., жуков рисового долгоносика Calandra oryzae L., свекловичной (бобовой) тли Aphys fabae Stock., а также обыкновенного паутинного клеща Tetranychus urticae Koch. Для нахождения величины СК50 вещество испытывали в последовательно увеличивающихся концентрациях и определяли % гибели биообъектов от каждой концентрации. Все опыты проводили в трехкратной повторности.
Авторы выражают благодарность сотрудникам института ВНИИХСЗР за помощь в проведении биологических тестов синтезированных соединений.
Список литературы
- Laskowski D.A. ReviewsofToxicology.// 2002, 174, 49.
- Галин Ф.З., Рахимов Р.Г., Вирипаев E.M., Богданов М.П., Амирханов Д.В., Толстиков Г.А. ЖOрХ. // 2002, 36, 826.
- Sun Kim S., Jun Kwack S., Da Lee R. // J Tox. Environ Health. 2005, 68, 2277.
- Ma, J., Huang, R., Feng, L., Chai, Y. Prog.// In NaturalCl. 2002, 12, 271.
- Mori T., Iwasaki T., Sugano M., Shono Y., Matsuo N. // Jap. Pat. 2003–206264. С.А.2003, 139:133688.
- Souda H., Iwakura K. // EP 1547995. С.А.2004, 140:99136.
- Ujihara K, Mori T, Iwasaki T, Sugano M, Shono Y, Matsuo N. // Biosсi. Biotech. Biochem. 2004, 68, 170.
- Brown S. M., Gott B. D. // PCT, 2003/053905. С.А. 2003,139:85510
- Nishii Y, Maruyama N, Wakasugi K, Tanabe Y. // Bioorg. Med Chem., 2001, 9, 33.
- Nägele, U.M., Hanack, M. // Lieb. Ann. 1989, 847.
- Wilkerson M. G., Norton S. // J. Agric. Food Chem., 1981, 29, 572.
- Nishii Y., Wakimura K., Tsuchiya T., Nakamura Sh., Tanabe Y. J. // Chem. Soc., Perkin Trans. 1. 1996, 1, 1243.
- Kondo K. // US 4999451. РЖХим. 1992, 1492П.
- Souda H., Iwakura K. // EP 1227077. С.А 2002 137:124945.
- Мирзабекова Н.С., Кузьмина Н.Е., Лукашов О И.,Соколова Н А., Голосов С.Н., Казаков П.В., Перлова Т.Г., Потапова В.В, Хейнман В.А., Иванова Г.Б.// ЖОрХ, 2008.Т.44, вып.8, стр.1153.
- Мирзабекова Н.С., Кузьмина Н.Е., Лукашов О И.,Соколова Н А., Голосов С.Н., Казаков П.В., Перлова Т.Г., Потапова В.В, Хейнман В.А., Иванова Г.Б. // ЖОрХ, 2009. 45.вып.3 стр. 367.
- Nagayama K., Kumar А., Wuthrich К., Ernst R. R. // J. Magn. Reson. 1980, 40, 321.
- Bax А., Subramanian S. // J. Magn. Reson. 1986, 67, 565.
- A. Bax and D. G. Davis, // J. Magn. Reson. 1985, 63, 207.
- Гар К.А. // Методы испытания токсичности и эффективности инсектицидов. М.: Наука, 1963, 296.
- Гордон А., Форд Р. // Спутник химика. М.: Мир, 1976, 544 с.
Статья представлена членом редколлегии А.Ф. Елеевым
Fluorine Notes, 2013, 91, 3-4


