Поступило в редакцию: ноябрь 2013
УДК 547.539+547-311+547-312+678
Fluorine Notes, 2013, 91, 1-2
Синтез полифторароматических олигоимидов с концевыми ангидридными группами - модификаторов-отвердителей эпоксидных смол
Т.А. Ваганова, С.З. Кусов, М.М. Митасов, Е.В. Малыхин*
Новосибирский институт органической химии имени Н.Н. Ворожцова СО РАН, Российская Федерация,
630090 Новосибирск, проспект Акад. Лаврентьева, 9.
e-mail: malykhin@nioch.nsc.ru
Аннотация. Разработана методика синтеза полифторароматических олигоимидов с концевыми ангидридными группами из оксидифталевого ангидрида и перфторароматических диаминов бензола, нафталина и бифенила. Продукты охарактеризованы методами ИК, ЯМР 1H и 19F спектроскопии, ВЭЖХ-МС и элементного анализа. Показано, что использование добавок полифторароматических модификаторов-отвердителей улучшает термостабильность и теплостойкость эпоксиангидридных полимеров.
Ключевые слова: Полифторарилендиамины, полифторароматические олигоимиды, эпоксиангидридные полимеры, термические свойства
Эпоксиангидридные полимеры, широко используемые как основа современных композитных электроизоляционных материалов [1], имеют большой потенциал для направленной модификации свойств. Характеристики материала могут быть изменены не только варьированием химического строения смолы и природы отвердителей, но и введением разнообразных органических и неорганических модификаторов и наполнителей. Модификация эпоксидных полимеров направлена, в первую очередь, на их упрочнение и увеличение трещиностойкости, а также на улучшение термостабильности, теплопроводящих и диэлектрических свойств. Для этого применяют микро- и наноразмерные неорганические допанты (оксиды, карбиды и нитриды алюминия, кремния, бора [2-5], различные формы наноструктурированного углерода [6-8] и т.д.) и термопластичные полимеры (полиэфиры [9], полидиметилсилоксаны [10], полиимиды [11]). Наиболее перспективным подходом считается получение гибридных материалов с использованием химических модификаторов, в том числе, олигомерных, которые при отверждении встраиваются в полимерную матрицу [12-14]. Например, добавки амино- и карбокситерминированных бутадиен-акрилонитрильных смол к нанонаполненным эпоксидным композициям пятикратно увеличивают энергию разрушения материала [12]. Гибридизация аминоотверждаемого эпоксидного полимера с бензоксазином способствует значительному увеличению его прочности и модуля гибкости [14]. Полифторалкилсодержащие оксираны, участвующие в формировании полимерной матрицы, повышают влагостойкость и температуру стеклования эпоксиангидридного полимера [13].
Нам представляется перспективным использовать в качестве модификаторов-отвердителей эпоксидной смолы полифторированные олигоимиды. Известно, что высокофторированные ароматические полиимиды обладают низкими диэлектрической проницаемостью и влагопоглощением, высокой термической и термоокислительной устойчивостью, хорошей адгезией к армирующим материалам, формируют тонкие прочные покрытия [15]. Можно полагать, что олигоимидные добавки улучшат комплекс необходимых свойств эпоксидной матрицы.
Целью настоящей работы является синтез олигоимидов с концевыми ангидридными группами на базе полифторированных диаминов с различным типом ароматического остова и проверка возможности их использования в качестве легирующих добавок для эпоксидных композиций.
Результаты и обсуждение
Ранее нами был разработан технологичный способ аминодефторирования полифтораренов с использованием безводного аммиака в качестве реагента и реакционной среды одновременно [16-18]. Получаемые таким способом индивидуальные диамины и смеси изомеров были с успехом использованы как мономеры для высокофторированных полиимидов [19], причем полиимид, полученный из недорогой смеси изомерных гексафтор-2,6- и -2,7-нафтилендиаминов не уступает по характеристикам полимеру на основе индивидуального 2,7-изомера. С учетом этого в качестве диаминных компонент для синтеза модификаторов выбраны продукты прямого бисаминирования базовых перфтораренов – смеси изомерных тетрафтор-1,3- и -1,4-фенилендиаминов (5:1) (4FPDA, основа модификатора М-1), гексафтор-2,6- и -2,7-нафтилендиаминов (4:1) (6FNDA, основа модификатора М-2), и 4,4'-диаминооктафторбифенил (8FBDA, основа модификатора М-3) (Схема 1). В качестве диангидридной компоненты использован промышленно производимый 4,4’-оксидифталевый ангидрид (ODPA).
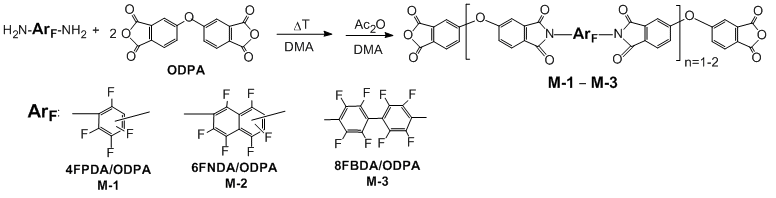
Схема 1. Синтез и структуры полифторированных олигоимидных модификаторов.
Для проведения конденсации диамин небольшими порциями прибавляли к раствору 2 эквивалентов ODPA в сухом ДMAА и выдерживали реакционную смесь при 70-80 °С до полного превращения диамина; степень конверсии контролировали методом ЯМР 19F. В зависимости от реакционной способности диамина продолжительность реакции варьировали от 15 до 25 ч. Циклодегидратацию образовавшихся амидокислот осуществляли действием уксусного ангидрида, после завершения реакции растворители удаляли в вакууме при температуре 150 °С.
Олигоимиды М-1 и М-2, полученные из смесей перфторированных фенилен- и нафтилендиаминов, соответственно, растворимы в полярных органических растворителях (ДМАА, N-метилпирролидоне, ДМСО), в том числе, легкокипящих хлороформе и ацетоне. Олигомер М-3 на основе перфторированного бифенила после полной имидизации становится практически нерастворимым.
Растворимые олигоимидные модификаторы М-1 и М-2 охарактеризованы методами ИК, ЯМР 1H и 19F спектроскопии, ВЭЖХ-МС и элементного анализа. Использованное соотношение диамина и диангидрида (1:2, соответственно) и последовательность смешения реагентов обеспечивают преимущественное образование диимидов с центральным перфторароматическим фрагментом и концевыми ангидридными функциями. Методом ВЭЖХ-МС зафиксированы также соединения с n=2 (см. схему 1) как минорные компоненты. Соотношение фторсодержащих и нефторированных фрагментов в продуктах определяли методом ЯМР с использованием 4,4'-диметоксиоктафторбифенила в качестве внутреннего стандарта. В спектрах ЯМР 19F олигоимидов присутствуют сигналы атомов фтора диимидного фрагмента, в спектрах ИК – полосы поглощения карбонильных групп в ангидридных и имидных фрагментах. Признаки наличия аминогрупп и амидокислотных фрагментов спектральными методами не зафиксированы. Строение нерастворимого модификатора М-3 подтверждали методами ИК спектроскопии и элементного анализа.
Влияние полифтоароматических олигоимидов на процесс отверждения и термические характеристики модифицированных эпоксиангидридных полимеров исследовано на примере композиций эпоксидной диановой смолы (DGEBA) и изометилтетрагидрофталевого ангидрида (IMTHPA), содержащих модификаторы М-1 – М-3 (1:10 по весу к DGEBA). Составы модифицированных композиций ЭМ 1–3 (таблица 1) рассчитаны с учетом стехиометрического соотношения ангидридных и эпоксидных групп: 0.52 экв отвердителя (М-1,2,3 + IMTHPA) на 100 г DGEBA с эпоксидным числом 22.5. Олигоимиды М-1 и М-2 растворяли при нагревании в IMTHPA; нерастворимый модификатор М-3, измельченный до размера частиц <10 мкм, диспергировали в IMTHPA ультразвуком до образования устойчивой суспензии. Отверждение проводили в присутствии каталитического количества бензилдиметиламина (BDMA) в ступенчатом режиме. Параллельно изготавливали образец сравнения эпоксиангидридного полимера (Э0), не содержащий модификатора.
Таблица 1. Состав и термические свойства модифицированных эпоксидных полимеров.
|
Эпоксидная композиция |
Температура стеклования, ДСК |
Термоокислительная стабильность, |
|||||
|
Шифр |
Состав, м.ч. |
||||||
|
DGEBA |
M |
IMTHPA |
BDMA |
Tс, °С |
T(5%), °С |
T(10%), °С |
|
|
Э0 |
100 |
86 |
1 |
121 |
345 |
377 |
|
|
ЭМ-1 |
100 |
10 |
82 |
1 |
134 |
356 |
387 |
|
ЭМ-2 |
100 |
10 |
82.4 |
1 |
135 |
348 |
373 |
|
ЭМ-3 |
100 |
10 |
82.7 |
1 |
126 |
354 |
380 |
Для контроля отверждения эпоксидных композиций использован метод ИК спектроскопии. В качестве примера на рис. 1 приведены спектры ЭМ-1 до и после отверждения. В спектрах исходных композиций, содержащих модификатор, присутствуют перекрывающиеся полосы поглощения С=О ангидридных групп в IMTHPA и фталевом фрагменте модификаторов М-1,2,3 (1852 и 1778 см-1). Исчезновение этих полос при отверждении указывает на полную конверсию ангидридных групп в модификаторах, в том числе, в нерастворимом М-3. Вместо них в спектрах отвержденных композиций появляется полоса поглощения С=О сложноэфирной группы (1734 см-1), образовавшейся при взаимодействии ангидридных и эпоксидного компонентов. В результате отверждения исчезают также перекрывающиеся полосы поглощения ангидридных (926 и 974 см-1) и эпоксидных (916 и 972 см-1) циклов. Карбонильным группам имидного фрагмента модификаторов в спектрах исходных композиций принадлежит интенсивная полоса поглощения при 1740 см-1, которая в отвержденной композиции перекрывается с поглощением сложноэфирной группы. Слабая полоса имидного карбонила при 1798-1800 см-1, закрытая в исходной смеси интенсивной полосой ангидридного карбонила, проявляется в спектрах отвержденных композиций. В целом, наблюдаемые изменения свидетельствуют о встраивании бифункционального олигоимидного модификатора в эпоксиангидридную матрицу.
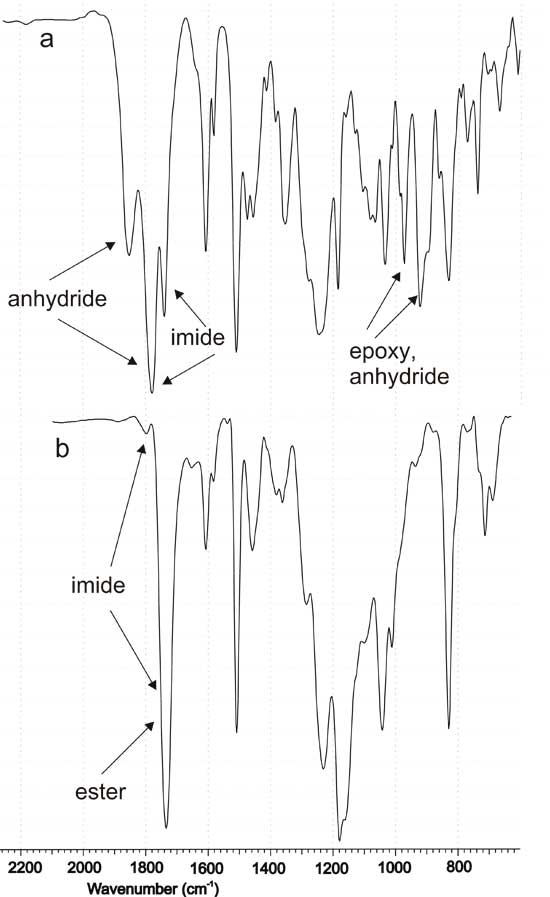
Рис. 1. ИК спектры модифицированной эпоксидной композиции ЭМ-1 до (а) и после (b) отверждения.
По данным ТГ-ДСК анализа модифицированные эпоксидные полимеры ЭМ-1,2,3, содержащие термостойкие полифторароматические имидные фрагменты, обладают улучшенными термическими характеристиками по сравнению с базовым Э0 (таблица 1). Заметный эффект на температуру стеклования, характеризующую теплостойкость полимера, оказывают модификаторы М-1 и М-2 на основе изомерных перфторарилендиаминов. Кроме того, при использовании модификаторов М-1 и М-3 наблюдается рост термоокислительной стабильности, определяемой по температуре потери 5 и 10 % веса.
Таким образом, разработана методика синтеза имидоангидридных модификаторов-отвердителей, содержащих полифторароматические фрагменты варьируемого строения. Показана перспективность этих веществ для получения эпоксидно-полиимидных матриц с улучшенными эксплуатационными характеристиками.
Экспериментальная часть
Спектры ЯМР 1H и 19F (δ, м.д.) регистрировали на приборе Bruker АV-300 (300.13 и 282.36 МГц, соответственно), в качестве внутреннего стандарта использовали сигналы остаточных протонов дейтерорастворителя и С6F6 (0 м.д.) соответственно. ИК спектры регистрировали на приборе Bruker Vector-22 в режиме ATR. ВЭЖХ-МС анализ проводили на жидкостном хроматографе Agilent-1200 и гибридном квадруполь-времяпролетном масс-спектрометре micrOTOF-Q Bruker. Метод ионизации API-ES; сканирование отрицательных ионов в диапазоне m/z 100-3000; поток газа-осушителя (азот) 4 л мин-1, 220 °C, 1.0 атм. Термогравиметрический анализ и дифференциальную сканирующую калориметрию выполняли на приборе NETZSCH STA 409 при скорости нагрева 10 °C мин-1 в атмосфере He или He/O2 (80/20). Размер частиц модификатора оценивали микроскопическим методом.
Смесь изомерных тетрафтор-1,3- и -1,4-фенилендиаминов в соотношении 5:1 (4FPDA) синтезировали по методике [17], смесь изомерных гексафтор-2,7- и -2,6-нафтилендиаминов в соотношении 4:1 (6FNDA) – по методике [16], 4,4'-диаминооктафторбифенил (8FBDA) – по методике [17], N,N-диметилбензиламин (BDMA) – по методике [20]. N,N-диметилацетамид (ДМАА) сушили перегонкой над P2O5 (остаточная влага 0.02 %). 4,4’-Оксидифталевый ангидрид (ODPA) очищен кристаллизацией из смеси уксусный ангидрид : уксусная кислота (1:1). Коммерческие реактивы: эпоксидиановая смола D.E.R. 330 (DGEBA), Dow Chemical Company, э.ч. 22.5; изометилтетрагидрофталевый ангидрид (IMTHFA), ТУ 8.103149-85; уксусный ангидрид, «ч».
Синтез модификаторов (типовая методика). В круглодонную колбу, снабженную обратным холодильником, помещают 0.2 моля ODPA и 250 мл ДМАА, перемешивают при 70-80 °C до полного растворения ангидрида, затем небольшими порциями прибавляют 0.1 моля полифторарилендиамина. Полученный раствор перемешивают при той же температуре до исчезновения исходного диамина (15-25 ч), контроль степени превращения осуществляют методом ЯМР 19F. Добавляют 1.4 моля уксусного ангидрида и выдерживают смесь в тех же условиях 5-6 ч. Растворители удаляют отгонкой при пониженном давлении, полученную пастообразную массу сушат в вакуумном шкафу (10-15 мм Hg) при температуре 150-180 °C.
Модификатор М-1 (4FPDA/ODPA). Выход 95 %. Интервал плавления 142-148 оС. ИК-спектр: 3076, 3105 (Caр-H), 1850, 1776, 1734 (С=О в ангидридных и имидных циклах). Спектр ЯМР 1Н (ацетон-d6): 7.76, 7.81, 8.16 (все м равной интегральной интенсивности). Спектр ЯМР 19F (ацетон-d6): 1,3-дизамещенный тетрафторфениленовый фрагмент – 1.9 (м, 1F, F5), 30.2 (м, 2F, F4, F6), 40.2 (м, 1F, F2); 1,4-дизамещенный тетрафторфениленовый фрагмент – 21.3 (м, 4F, F2, F3, F5, F6). ВЭЖХ-МС: основной пик [M+OH]- 781.06, С38H12F4N2O12+OH, вычислено 781.50; минорный пик [M+OH]- 1235.03, С60H18F8N4O17+OH, вычислено 1235.79. Найдено: C 59.0, H 1.54, N 3.05, F 8.94. Вычислено для С38H12F4N2O12: C 59.7, H 1.57, N 3.66, F 9.95.
Модификатор М-2 (6FNDA/ODPA). Выход 96 %. Интервал плавления 162-170 оС. ИК-спектр: 3076, 3105 (Caр-H), 1852, 1776, 1734 (С=О в ангидридных и имидных циклах). Спектр ЯМР 1Н (ацетон-d6+DMСO-d6): 7.65, 7.80, 8.16 (все м равной интегральной интенсивности). Спектр ЯМР 19F (ацетон-d6+DMСO-d6): 2,7-дизамещенный гексафторнафтиленовый фрагмент – 16.0 (м, 2F, F4, F5), 25.5 (м, 2F, F3, F6), 43.4 (м, 2F, F1, F8); 2,6-дизамещенный гексафторнафтиленовый фрагмент – 17.6 (м, 2F, F4, F8), 23.0 (м, 2F, F3, F7), 41.6 (м, 2F, F1, F5). ВЭЖХ-МС: основной пик [M+OH]- 867.04, С42H12F6N2O12+OH, вычислено 867.54; минорный пик [M+OH]- 1407.00, С68H18F12N4O17+OH, вычислено 1407.87. Найдено: C 59.2, H 1.33, N 2.97, F 13.2. Вычислено для С42H12F6N2O12: C 59.3, H 1.41, N 3.29, F 13.4.
Модификатор М-3 (8FBDA/ODPA). Выход 98 %. Не плавится до 300 оС. ИК-спектр: 3078, 3105 (Caр-H), 1852, 1778, 1734 (С=О в ангидридных и имидных циклах). Найдено: C 57.5, H 1.23, N 2.73, F 16.9. Вычислено для С44H12F8N2O12: C 57.9, H 1.32, N 3.07, F 16.7.
Приготовление модифицированных эпоксидных композиций. Модификатор М-1 или М-2 растворяют в IMTHPA при перемешивании и нагревании до 100-120 °C, охлаждают до комнатной температуры. Нерастворимый модификатор М-3, измельченный в шаровой вибромельнице до размера частиц 5-7 мкм, гомогенизируют в IMTHPA с помощью ультразвука в течение 20 мин. К полученному раствору или суспензии прибавляют DGEBA, подогретую до 50 °C, смесь перемешивают и добавляют BDMA. Составы композиций приведены в таблице 1. Полученную смесь подвергают ультразвуковой гомогенизации в течение 4-6 мин и помещают в силиконовую форму, дегазируют в вакуумном шкафу в течение 0.5 ч при 40 °C. Отверждение производят в ступенчатом режиме: скорость нагрева 2 °C мин-1, выдержка 100 °C/2 ч + 160 °C/10 ч.
Работа выполнена при финансовой поддержке гранта № 97 СО РАН (партнерские фундаментальные исследования 2012-2014 гг).
Авторы благодарят к.х.н. И.К. Шундрину за выполнение ТГ-ДСК анализа эпоксидных полимеров, к.х.н. В.Г. Васильева – за ВЭЖХ-МС анализ олигоимидов.
Список литературы
- Михайлин, Ю.А. Термоустойчивые полимеры и полимерные материалы // СПб: Профессия, 2006. 624 с; Petrie, E.M. Epoxy adhesive formulations // New-York: McGraw-Hill; 2006. 534 p
- Kochetov, R., Andritsch, T., Morshuis, P.H.F., Smit, J.J. Dielectric response and thermal conductivity of epoxy resin filled with nanoalumina particles of different size in α, γ and δ phase // Electrical Insulation and Dielectric Phenomena (CEIDP), 2010 Annual Report Conference, 1–4, DOI 10.1109/CEIDP.2010.5723963.
- Li, H., Zhang, Z., Ma, X., Hu, M., Wang, X., Fan, P. Synthesis and characterization of epoxy resin modified with nano-SiO2 and γ-glycidoxypropyltrimethoxy silane // Surf. Coat. Technol. 2007, vol. 201, N 9-11, p. 5269-5272.
- Yung, K. C., Liem, H. Enhanced Thermal Conductivity of Boron Nitride Epoxy-Matrix Composite Through Multi-Modal Particle Size Mixing // J. Appl. Polym. Sci. 2007, vol. 106, N 6, p. 3587-3591.
- Fua, J.-F., Shia, L.-Y., Zhong, Q.-D., Chena, Y., Chen, L.-Y. Thermally conductive and electrically insulative nanocomposites based on hyperbranched epoxy and nano-Al2O3 particles modified epoxy resin // Polym. Adv. Technol. 2011, vol. 22, N 6, p. 1032-1041.
- Geng, Y., Liu, M.Y., Li, J., Shi, X.M., Kim, J.K. Effects of surfactant treatment on mechanical and electrical properties of CNT/epoxy nanocomposites // Composites: Part A 2008, vol. 39, N 12, p. 1876-1883.
- Lee, Y.S., Cho, T.H., Lee, B.K., Rho, J.S., An, K.H., Lee, Y.H. Surface properties of fluorinated single-walled carbon nanotubes // J. Fluorine Chem. 2003, vol. 120, N 2, p. 99-104.
- Gabriel, G., Sauthier, G., Fraxedas, J., Moreno-Manas, M., Martinez, M.T. Miravitlles, C. Preparation and characterization of single-walled carbon nanotubes functionalized with amines // Carbon 2006, vol. 44, N 10, p. 1891-1897.
- Flores, M., Fernández-Francos, X., Ferrando, F., Ramis, X., Serra, A. Efficient impact resistance improvement of epoxy/anhydride thermosets by adding hyperbranched polyesters partially modified with undecenoyl chains // Polymer 2012, vol. 53, N 23, p. 5232-5241; Foix, D., Ramis, X., Ferrandoc, F., Serra, A. Improvement of epoxy thermosets usinga thiol-ene based polyester hyperbranched polymer as modifier // Polym. Int. 2012, vol. 61, N 5, p. 727-734.
- Rey, L., Poisson, N., Maazouz, A., Sautereau, H. Enhancement of crack propagation resistance in epoxy resins by introducing poly(dimethylsiloxane) particles // J. Mater. Sci. 1999, vol. 34, N 8, p. 1775-1781.
- Hay, J.N., Woodfine, B., Davies, M. Toughening of epoxy resins by polyimides synthesized from bisanilines // High Perform. Polym. 1996, vol. 8, N 1, p. 35–56; Gaw, K.O., Kakimoto, M. Polyimide-Epoxy Composites // Adv. Polym. Sci. 1999, vol. 140, p. 107-136.
- Hsieh, T. H., Kinloch, A. J., Masania, K., Sohn Lee, J., Taylor, A. C., Sprenger, S. // The toughness of epoxy polymers and fibre composites modified with rubber microparticles and silica nanoparticles // J. Mater. Sci. 2010, vol. 45, N 3, p. 1193-1210.
- Федосеев, М.С., Державинская, Л.Ф., Карманов, В.И., Бажин, Д.Н., Запевалов, А.Я., Горбунова, Т.И., Салоутин, В.И. Синтез и свойства эпоксиангидридных полимеров, модифицированных полифторалкилсодержащими оксиранами при их отверждении // Журн. прикл. химии. 2010, т. 83, вып. 4, с. 671-675; Федосеев, М.С., Глушков, В.А., Державинская, Л.Ф., Крайнова, Г.Ф., Тиунова, Т.Г. Синтез и свойства эпоксиангидридных полимеров, модифицированных оксиранами тетрагидрохинолинового ряда при их отверждении // Журн. прикл. химии. 2011, т. 84, вып. 9, с. 1547-1550.
- Grishchuk, S., Mbhele, Z., Schmitt, S., Karger-Kocsis, J. Structure, thermal and fracture mechanical properties of benzoxazine-modified amine-cured DGEBA epoxy resins // eXPRESS Polym. Let. 2011, vol. 5, N.3, p. 273-282.
- Hougham, G. Fluorine-Containing Polyimides // G. Hougham (Ed.), Fluoropolymers 2: Properties, Kluwer Academic/Plenum Publishers, New York, 1999, p. 233-276.
- Vaganova, T.A., Kusov, S.Z., Rodionov, V.I., Shundrina, I.K., Sal’nikov, G.E., Mamatyuk, V.I., Malykhin, E.V. Amination of octafluoronaphthalene in liquid ammonia. 2,6- and 2,7-Diaminohexafluoronaphthalenes selective preparation // J. Fluor. Chem. 2008, vol. 129, N 4, p. 253-260.
- Ваганова, Т.А., Кусов, С.З., Родионов, В.И., Шундрина, И.К., Малыхин, Е.В. Селективное моно- и диаминирование полифторированных производных бензола и пиридина жидким аммиаком // Изв. АН. Сер. хим. 2007, N 11, c. 2163-2170.
- Vaganova, T.A., Kusov, S.Z., Rodionov, V.I., Shundrina, I.K., Malykhin, E.V. Direct di- and triamination of polyfluoropyridines in anhydrous ammonia // J. Fluor. Chem. 2009, vol. 130, N 5, p. 461-465.
- Малыхин, Е.В., Ваганова, Т.А., Шундрина, И.К., Кусов, С.З., Родионов, В.И., Карпова, Е.В. Полиимиды AA/BB- и AB-типов на основе новых перфторированных мономеров // Химия в интересах устойчивого развития. 2011, т. 19, N 6, c. 661-668; Shundrina, I.K., Vaganova, T.A., Kusov, S.Z., Rodionov, V.I., Karpova, E.V., Koval, V.V., Gerasimova, Yu.V., Malykhin, E.V. Synthesis and characterization of polyimides based on novel isomeric perfluorinated naphthylenediamines // J. Fluor. Chem. 2009, vol. 130, N 8, p. 733-741.
- Tayama, E., Kimura, H. Asymmetric Sommelet–Hauser Rearrangement of N-Benzylic Ammonium Salts // Angew. Chem., Int. Ed. 2007, vol. 46, N 46, p. 8869-8871.
Статья рекомендована к публикации членом редколлегии В.Е. Платоновым
Fluorine Notes, 2013, 91, 1-2


