Поступило в редакцию: май 2013
УДК 541.64; 547.321
Fluorine Notes, 2013, 89, 3-4
Стереоселективность протонирования аддуктов перфтораллилбензола с N-метилпирролом
И.Ю. Бабкин, О.П. Юдина, С.Е. Галан, А.Ю. Ламанов, А.Ф. Елеев
Федеральное государственное унитарное предприятие "Государственный научно-исследовательский институт
органической химии и технологии", 111024, Москва, шоссе Энтузиастов, 23
e-mail: dir@gosniiokht.ru
Аннотация. Реакция N-метилпиррола с перфтораллилбензолом приводит к образованию продуктов [2+4]-циклоприсоединения в смеси экзо- и эндо-изомеров. Различие реакционной способности стереоизомеров полученного аддукта позволяет разделить и выделить стерео-изомеры количественно в индивидуальном виде как химическим способом, так и посредством флэш-хроматографии с использованием в качестве сорбента сферического силикагеля повышенной плотности (размер частиц 15 мкм), а в качестве элюента – хлороформа (или хлористого метилена).
Ключевые слова:N-метилпиррол, перфтораллилбензол, [2+4]-циклоприсоединение, 5,5,6-трифтор-6-экзо-полифторалкил- и 5,5,6-трифтор-6-эндо-полифторалкил-7-азабицикло-[2.2.1]гепт-2-ены, флеш-хроматография, спектры ЯМР 1Н, 19F и 13С, HSQC и COSY-спектры, масс-спектрометрия.
Ранее [1-3], было показано, что пиррол взаимодействует с фторолефинами с образованием аддуктов различного структурного типа. Так, взаимодействие пиррола с перфтораллилбензолом осуществляется с образованием продукта [2+4]-циклоприсоединения [4]. Разделение, образующейся в реакции стерео-изомерной смеси, было осуществлено с использованием флэш-хроматографии.
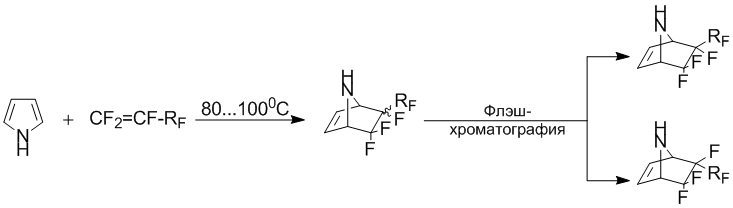
Как правило, наличие не замещенного атома азота пиррольного ядра может промотировать образование различных побочных продуктов [1, 4]. В связи с этим, было оценено изменение реакционной способности пиррольного ядра введением метильной группы по атому азота. Так, выдерживание смеси N-метилпиррола и перфтораллил-бензола при постоянном перемешивании и при температуре 80–130°С в течение 10 суток приводит лишь к образованию аддукта [2+4]-цикло-присоединения (1) в виде смеси стереоизомеров относительно перфторбензильной группы.
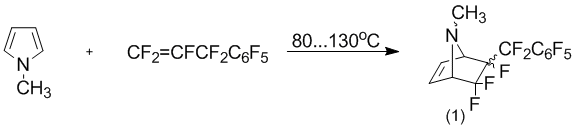
Как и было показано ранее [1], разделение стерео-изомерной смеси соединения (1) может быть осуществлено флэш-хроматографией с применением в качестве сорбента просеянного сферического силикагеля повышенной плотности с размером частиц 15 мкм.

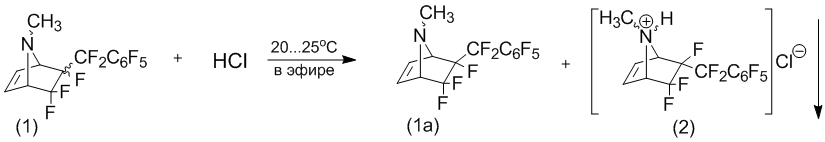
Однако, необходимо отметить, что полученные стерео-изомеры обладают существенно различной реакционной способностью в реакции с газообразным хлористым водородом в эфире. Так, оказалось, что экзо-перфторбензил-стереоизомер (1а) вообще не реагирует с хлористым водородом, в то время как эндо-изомер (1б) с количественным выходом превращается в гидрохлорид.
Причем, введение избытка газообразного хлористого водорода в эфирный раствор соединения (1), представляющего смесь стерео-изомеров, приводит к образованию гидрохлорида только 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептена-2 (2) в виде белого кристаллического осадка. 6-Экзо-перфторбензил-стереомер (1а) остаётся в растворе без изменений, поэтому отделение эндо-стереоизомера гидрохлорида (2) от экзо-стереоизомера, препаративно, не представляет трудности.
Обработкой гидрохлорида (2) гидроксидом натрия получают 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептен-2 в форме основания (1б).
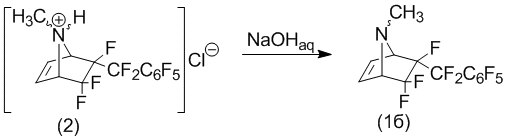
В свою очередь, взаимодействие такого же структурного типа соединения, как 6-перфторбензил-5,5,6-трифтор-7-азабицикло[2.2.1]-гептена-2 [1] с хлористым водородом не является стерео-селективным.
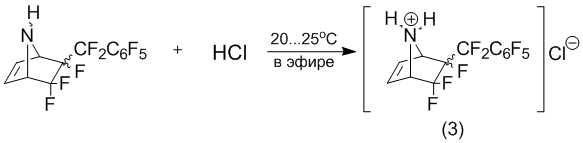
Причем, образование гидрохлорида (3) не является стерео-селективным даже при введении 1/10 эквивалента хлористого водорода.
Таким образом, введение метильной группы по атому азота фторсодержащего 7-азабицикло[2.2.1]гептена-2 приводит к различной реакционной способности стерео-изомеров. Например, реализуется возможность разделения смеси изомеров (1а) и (1б) обработкой хлористым водородом.
Экспериментальная часть
Структура синтезированных соединений подтверждена данными масс-, ЯМР 1Н, 19F, 13С, HSQC и COSY-спектров.
Спектры ЯМР 1Н, 19F, 13С, HSQC и COSY получены на спектрометре «Agilent DD2 NMR System 600» при температуре 250°С по стандартным методикам 1D и 2D экспериментов. В качестве растворителей использовали дейтерированные диметилсульфоксид и хлороформ. Химические сдвиги в спектрах ЯМР приведены в шкале δ относительно внутреннего стандарта: тетраметилсилана (1Н, 13С) и трифторуксусной кислоты (19F).
Масс-спектры сняты на хромато-масс-спектрометре с масс-детектором НР 5975С, 70 эВ.
N-метил-5,5,6-трифтор-6-перфторбензил-7-азабици-кло[2.2.1]гептен-2 (1). Колбу Эрленмейера, ёмкостью 250 мл, снабжают якорем магнитной мешалки, Ч-образной трубкой с обратным холодильником и трубкой ввода аргона. В колбу помещают 8,1 г (0,1 моль) N-метилпиррола и 29,8 г (0,1 моль) перфтораллилбензола. Полученную смесь перемешивают в атмосфере аргона при 90–100°С в течение 10 суток. Охлаждают до комнатной температуры. Исходные реагенты упаривают в вакууме. Остаток растворяют в 50 мл хлороформа и фильтруют через силикагель, промывая 300 мл хлороформа. Растворитель упаривают. Получают 26,4 г (69,6 %) N-метил-5,5,6-трифтор-6-перфторбензил-7-азабицикло[2.2.1]гептена-2 (1) в виде смеси стерео-изомеров.
Разделение стерео-изомеров N-метил-5,5,6-трифтор-6-перфторбензил-7-азабицикло[2.2.1]гептена-2 (1) флэш-хроматографией.
Разделение осуществляют на картридже с просеянным сферическим силикагелем с размером частиц 15 мкм и массой 300 г (Interchim, PF 15SIHP/300G). Элюент – хлористый метилен.
25,0 г N-метил-5,5,6-трифтор-6-перфторбензил-7-азабицикло-[2.2.1]гептена-2 (1) в виде смеси стерео-изомеров растворяют в 25 мл хлористого метилена. Полученный раствор вводят в насыщенный элюентом картридж. Выделяют поочерёдно 11,2 г 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабици-кло[2.2.1]гептена-2 (1б) , т.пл. 89,7°С.; а затем 13,4 г 6-экзо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептен-2 (1а), т.пл. 77,9°С.
Идентификацию соединений по фракциям осуществляют с использованием ГХ-масс-спектрометрии.
Гидрохлорид 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептена-2 (2) и 6-экзо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептен-2 (1а).
20,0 г соединения (1) растворяют в 200 мл безводного диэтилового эфира. При интенсивном перемешивании реакционной массы вводят сухой хлористый водород до прекращения выпадения белого кристаллического осадка. Выпавший осадок фильтруют, промывают диэтиловым эфиром. Получают 9,8 г (количественно) гидрохлорида 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гепте-на-2 (2) , т.пл. 167,7°С. Фильтрат упаривают и сушат в вакууме при 1 мм рт.ст. 4 часа. Получают 9,3 г 6-экзо-перфторбензил-стереоизомера (1а).
6-Экзо-перфторбензил-N-метил-5,5,6-трифтор-7-азабици-кло[2.2.1]гептен-2 (1а):
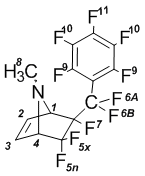
Спектр ЯМР 1Н (в СDCl3): 2,11 с (8-Н, 3Н); 3,87 д м (4-Н, J5x-4 = 6 Гц, 1Н); 4,32 м (1-Н, 1Н); 6,35 д.м (2-Н, J2-3 = 6 Гц, 1Н); 6,39 д.м (3-Н, J3-2 = 6 Гц, 1Н).
Спектр ЯМР 19F (в СDCl3): –113,95 д м (5x-F, J5x-5n = 230 Гц, 1F); 105,57 д (5n-F, J5n-5x = 230 Гц, 1F); 97,85 д.д.кв (6A-F, J6A-6B = 283 Гц, 1F); –102,17 д т (6В-F, J6B-6A = 283 Гц, J = 35,2 Гц, 1F); 167,79 м (7-F, 1F); 161,42 т (9-F, J = 18,5 Гц, 2F); –136,48 м (10-F, 2F); 149,57 т (11-F, J = 21 Гц, 1F).
Спектр ЯМР 13С (в СDCl3): 32,8 с (8-С); 70,0 д (1-С, J = 25,1 Гц); 72,1 дд (4-С, J’ = 22,4 Гц, J’’ = 26,5 Гц); 118,9 д (CF); 120,7 д (CF); 122,5 д (CF); 131,9 с (3-C); 132,7 с (2-C); 137,1 м (CF); 138,8 м (CF); 141,9 м (CF); 144,8 м (CF); 146,5 м (CF).
Масс-спектр, m/z (%): 379 (M+, 1); 360 ([M-F]+, 4); 298 ([C9F10]+, 8); 279 ([C9F9]+, 7); 248 ([C8F8]+, 8); 217 ([C7F7]+, 26); 167 ([C6F5]+, 4); 81 (C5H7N+, 100).
6-Эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептен-2 (1б)
12,0 г гидрохлорида (2) помещают в 100 мл 2н раствора гидроксида натрия. Встряхивают в течение 10…15 минут и экстрагируют хлористым метиленом (4 раза по 50 мл). Экстракт сушат над безводным сульфатом натрия. Декантируют. Растворитель упаривают в вакууме. Получают 10,5 г (95,9%) 6-эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабицикло[2.2.1]гептена-2 (1б), т.пл. 89,7оС.
6-Эндо-перфторбензил-N-метил-5,5,6-трифтор-7-азабици-кло[2.2.1]гептен-2 (1б):
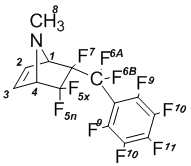
Спектр ЯМР 1Н (в СDCl3): 2,25 с (8-Н, 3Н); 3,84 д.м (4-Н, J5x-4 = 5 Гц, 1Н); 3,96 д.м (1-Н, J1-7 = 4,5 Гц, 1Н); 6,39 д.м (2-Н, J2-3 = 6 Гц, 1Н); 6,41 д.м (3-Н, J3-2 = 6 Гц, 1Н).
Спектр ЯМР 19F (в СDCl3): –109,8 д.м. (5x-F, J5x-5n = 228 Гц, 1F); –106,7 д. (5n-F, J5n-5x = 228 Гц, 1F); 101,6 д.д.кв (6A-F, J6A-6B = 290 Гц, J = 10,4 Гц, J = 21,0 Гц, 1F); –96,1 д.т (6В-F, J6B-6A = 290 Гц, J = 25,2 Гц, 1F); –165,1 м. (7-F, 1F); 160,0 т (9-F, 2F); –137,4 м (10-F, 2F); –148,3 т. (11-F, J = 20,5 Гц, 1F).
Спектр ЯМР 13С (в СDCl3): 33,3 с (8-С); 71,7 дд (1-С, J’ = 22 Гц, J’’ = 27 Гц); 72,5 дд (4-С, J’ = 3 Гц, J’’ = 19 Гц); 121,4 (CF); 123,1 (CF); 131,5 (3-C); 131,8 (2-C); 137,3 д (CF); 139,0 (CF); 142,3 (CF); 144,6 (CF); 146,3 (CF).
Масс-спектр, m/z (%): 379 (M+, 1); 360 ([M-F]+, 2); 298 ([C9F10]+;7); 279 ([C9F9]+; 3); 248 ([C8F8]+; 5); 217 ([C7F7]+; 23); 67 ([C5H7N]+; 100).
Гидрохлорид 5,5,6-трифтор-6-перфторбензил-7-азабици-кло[2.2.1]гептена-2 (3)
5,0 г 5,5,6-трифтор-6-перфторбензил-7-азабицикло[2.2.1]гептена-2 (3) растворяют в 50 мл безводного диэтилового эфира. При интенсивном перемешивании реакционной массы вводят сухой хлористый водород до прекращения выпадения кристаллического осадка. Выпавший осадок фильтруют, промывают диэтиловым эфиром. Получают 5,5 г (количественно) стерео-изомерную смесь гидрохлоридов 6-эндо-перфторбензил-5,5,6-трифтор-7-азабицикло[2.2.1]гептена-2 (3).
Список литературы
- Kobayashi Y., Honda M., Hanzawa Y., Kumsdaki I., J. Chem. Soc., Perkin. Trans. 1, 1970, p. 1743.
- Kobayashi Y., Kumsdaki I., Ohsawa A., Sekine Y., Ando A. Studies on Organic Fluorine Compounds. Part 23. Diels-Alder Reactions 1,2,3,4-Tenrakis(trifluoromethyl)-5-thiabicyclo[2.1.0]pent-2-ene. – J. Chem. Soc., Perkin. Trans. 1, 1977, pp. 2355…2357.
- Barlow M.G., Haszeldine R.N., Hubbard R. Valence-bond Isomer Chemistry. Part II. Diels-Alder Reactions of Hexafluorobicyclo[2.2.0]hexa-2,5-diene. Pyrrole as a diene. , J. Chem. Soc. (C), 1971, Iss. 1, pp.90…95.
- Бабкин И.Ю., Юдина О.П., Галан С.Е., Моисеев С.В., Елеев А.Ф. Аддукты пиррола с фторсодержащими олефинами. // Fluorine notes: сетевой журн., 2013, vol, 3(88), URL: /public/2013/3_2013/letters/rusletter2.html (дата обращения 05.07.2013)
Статья представлена членом редколлегии профессором А.Ф.Елеевым.
Fluorine Notes, 2013, 89, 3-4


