Поступило в редакцию: декабрь 2012
УДК 542.941:547.446
Fluorine Notes, 2013, 87, 7-8
Синтез пентафторацетонильных производных на основе иодпентафторацетона
Н.Д. Каграмановa, А.А. Тютюновab, С.Р. Стерлинa
a Федеральное государственное бюджетное учреждение науки Институт элементоорганических
соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул.
Вавилова, д. 28
b ЗАО НПО "ПиМ-Инвест", 119991, Москва, ул. Вавилова, д. 28
e-mail: tuytuynov@rambler.ru
Аннотация. Иодпентафторацетон гладко димеризуется в присутствии меди с образованием перфторацетонилпропенилового эфира. В условиях термического инициирования получены аддукты иодпентафторацетона с этиленом и тетрафторэтиленом. Изучены превращения 2-(перфторацетонил)этилиодида
Ключевые слова:иодпентафторацетон, этилен, тетрафторэтилен.
Ранее было найдено, что термолиз иодпентафторацетона (1) (автоклав, 250°С/25 час) приводит к образованию перфторацетонилпропенилового эфира (2) – продукта О-С-димеризации 1 [1]. По мнению авторов, реакция осуществляется по схеме, включающей в себя гомолиз C-I-связи в 1 с последующей атакой генерируемого перфторацетонильного радикала (3) по атому кислорода карбонильной группы второй молекулы 1 и элиминирование радикала иода из иоддифторметильной группы.
Чрезвычайно жесткие условия реакции, несмотря на ожидаемую легкость гомолиза С-I-связи в 1, в ходе которого генерируется относительно стабильный гетероаллильный радикал 3, по всей вероятности связаны с обратимым характером гомолитического распада.
Нами найдено, что в присутствии Cu-порошка в качестве акцептора иода ацетон 1 при 90-100°С образует димер 2 с количественным выходом.
Схема 1
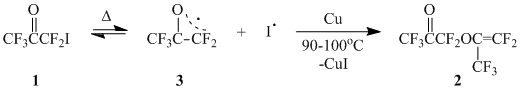
Легкость гомолиза ацетона 1 позволяет использовать реакции радикального присоединения 1 к непредельным соединениям как удобный метод введения перфторацетонильной группы в органические соединения.
Действительно, ацетон 1 в условиях термического инициирования гладко присоединяется к этилену с образованием аддукта 4 – исходного соединения для получения оксолана 5 внутримолекулярной циклизацией 4 в присутствии CsF. Омыление 4 в условиях, описанных в работе [2], привело к образованию оксиоксолана 6 – продукта внутримолекулярной циклизации первоначально образующегося карбинола 6а.
Схема 2
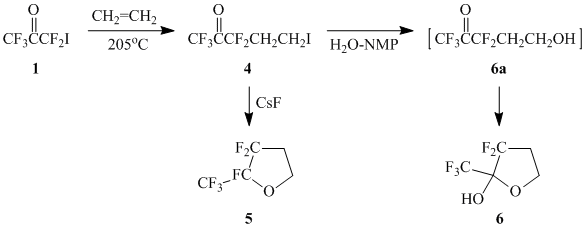
Дегидратацей оксиоксолана 6 под действием P2O5 был получен олефин 7. Разумеется, непосредственным предшественником кетоолефина 7 является карбинол 6а, однако полукеталь 6 весьма стабилен, и смещение равновесия 6 ↔ 6а вправо осуществляется с заметной скоростью лишь при ~300°С (нагревание реакционной смеси на пламени горелки):
Схема 3

Реакция 1 с тетрафторэтиленом (автоклав, 205°С) приводит к образованию аддукта 8 (Схема 4), однако в этом случае в качестве побочного продукта образуется 1,2-дииодтетрафторэтан (9), образующий с 8 азеотропную смесь; аналитически чистый образец 8 выделить не удалось. Строение 8 было установлено на основании данных хроматомасс-спектроскопии и ЯМР 19F.
Схема 4
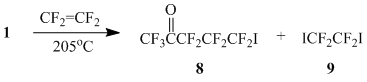
Таким образом, вышеприведенные примеры показывают, что реакции радикального присоединения иодпентафторацетона к фторированным и нефторированным этиленам и дальнейшие превращения образующихся аддуктов являются удобным методом введения перфторацетонильной группы в различные классы органических соединений.
Экспериментальная часть
ЯМР 1H, 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 300 и 282 MHz, соответственно, внешний стандарт CDCl3 или D2O. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7.25, 4.79) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CF3COOH. Слабопольные сдвиги имеют положительное значение. Раман спектры записаны на Раман спектрометре Jobin Yvon LabRam. Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra).
Иодпентафторацетон (1) получен по методу [3].
Димеризация иодпентафторацетона в присутствии меди
Смесь иодпентафторацетона (1) (30 г, 0,109 моль) порошкообразной меди (7 г, 0,11 г-атома) нагревали в запаянной стеклянной ампуле при 100°С/3 часа, образовавшийся димер 2 (16,1 г, выход количественный) эвакуировали в приемник (-78°С) при пониженном давлении. Спектр ЯМР 19F полученного продукта идентичен спектру, описанному в [1]. Последующей перегонкой дистиллята выделено 15,5 г 2, т.кип. 69-70°С (лит. данные: т.кип. 65-72°С [1]).
Реакция иодпентафторацетона с этиленом.
Смесь 1 (25 г, 91 ммол) и этилена (6 л, 240 ммол) нагревали при 200°С/10 час, по окончании реакции жидкую часть реакционной массы (27 г) перегнали и получили 24,6 г (89%) аддукта 4, т.кип. 70-79°С/85 Torr.
Повторной перегонкой выделен аналитический образец 4, т.кип. 71-72°С/85 Torr. Найдено (%): C, 19,86; H, 1,33; F, 31,46. C5H4F5IO. Вычислено (%): C, 19,85; H, 1,33; F, 31,23. КР-спектр (ν, сm-1): 1788 (С=О). ЯМР 1H δ: 2,53, (с, 2H, CH2I), 2,98, (с, 2H, CF2CH2); ЯМР 19F δ: -1,83, (с, 3F, CF3), 31,25 (с, 2F, CF2).
Получение оксолана 5.
Смесь кетоиодида 4 (9 г, 30 ммол), CsF (5 г, 33 ммол) и 25 мл диглима перемешивают при 35-40°С/6 час, фильтруют, фильтрат промывают разб. HCl-к-той, экстрагируют эфиром, экстракт сушат MgSO4, упаривают, остаток (3,9 г) содержит исходный кетоиодид 4 и оксолан 5 в соотношении 1:9. Перегонкой остатка выделяют 3,5 г фракции с т.кип. 106-135°С, содержащей ~95% оксолана 5 (ГЖХ, ЯМР 19F), выход 75% в расчете на 4, вступивший в реакцию.
Повторной перегонкой получают аналитический образец 5, т.кип. 114-115°С. Найдено (%): С, 30,72; H, 2,06; F, 58,43. C5H4F6O. Вычислено (%): С, 30,92; H, 2,06; F, 58,76. ЯМР 19F δ: 2,45 (дт, 3F, 3JCF3-CF = 13 Hz, 4JCF3-CF2 = 2,9 Hz, CF3), AB-квартет с центром 36,35 (2F, JAB = 245,3 Hz, CF2), 44,8 (уш.с, 1F, CF).
Синтез оксиоксолана 6.
Смесь кетоиодида 4 (24,6 г, 81,46 ммоля), 3,8 г (210 ммоля) H2O и 160 г NMP перемешивают при 150°С/13 час, выливают в 400 мл H2O, экстрагируют эфиром (4х50 мл), экстракт упаривают, перегонкой остатка выделяют 19 г фракции с т.кип. 60-110°/17Torr.
Повторной перегонкой выделяют 12,5 г (78%) 6, т.кип. 72-98oC/30 Torr. Найдено (%): С, 30,27; H, 2,77; F, 48,12. C5H5F5O2.0,25H2O. Вычислено (%): С, 30,53; H, 2,80; F, 48,35. ЯМР 1H δ: 2,25÷2,40 (м, 2H), 3,94÷4,01 (м, 2H). ЯМР 19F δ: 3,93 + 3,94 (д, 3F, JCF3-OH = 14 Hz, CF3), AB-квартет с центром 36,5 (2F, JAB = 240.6 Hz, CF2). Масс-спектр 6 (m/z, отнесение): 193 [M+H]+; 175 [M-OH]+; 153 [C5H4F3O2]+; 148 [C3HF5O]+; 135 [C5H2F3O]+; 123 [M-CF3]+; 103 [C4H4FO2]+; 95 [C3H5F2O]+; 83 [C4H3O2]+; 77 [C3H3F2]+ (100%); 75 [C3HF2]+; 69 [CF3]+; 64 [C2H2F2]+; 55 [C3F]+; 51 [CHF2]+; 45 [C2H5O]+; 39 [C3H3]+.
Получение кетоолефина 7.
Смесь 6 (13,2 г, 70 ммол) и P2O5 (9,5 г, 77 ммол) нагревают на пламени горелки, собирая дистиллят в приемник (0°С). Перегонкой дистиллята получают 6,1 г (51%) кетоолефина 7, т.кип. 48-50°С.
Найдено (%): С, 34,65; H, 1,67; F, 54,88. C5H3F5O. Вычислено (%): С, 34,48; H, 1,72; F, 54,60. КР-спектр (ν, сm-1): 1651,0 (С=С); 1788,6 (С=О). ЯМР 1H δ: 6,27÷6,55 (м). ЯМР 19F δ: 1,96 (с, 3F, CF3), 30,38 (с, 2F, CF2).
Реакция иодпентафторацетона с тетрафторэтиленом.
Смесь 1 (29 г, 106 ммол) и тетрафторэтилена (3,25 л, 130 ммол) нагревали в стальном автоклаве емк. 100 мл при 205°С/11 час. По окончании реакции получили 34,1 г смеси, содержащей по данным ЯМР 19F 10% исходного кетона 1, 20% 1,2-дииодтетрафторэтана (9) и 70% γ-гексафторпропилтрифторметилкетона (8) (выход 68% на 1, вступивший в реакцию). Перегонкой было выделено 30,5 г фракции (98-115oC), содержащей соединения 8:9 = 78:22, которые не удалось разделить фракционированием. Строение аддукта 8 установлено на основании данных ХМС и ЯМР 19F.
ЯМР 19F δ: -17,8 (с, 2F, CF2I), 1,5 (с, 3F, CF3), 36,5 (с, 2F, C(O)CF2), 40,5 (с, 2F, CF2). Масс-спектр 8 (m/z, отнесение): 375 [M+H]+; 355 [M-F]+; 277 [C3F6I]+; 247 [M-I]+ (100%); 239 [C3F4I]+; 227 [C2F4I]+; 208 [C2F3I]+; 181 [C4F7]+; 177 [CF2I]+; 169 [C3F7]+; 131 [C3F5]+; 100 [C2F4]+; 97 [C2F3O]+; 69 [CF3]+.
Список литературы
- A.Yu. Volkonskii, G.G. Bargamov, E.M. Rokhlin, Russ. Chem. Bull., 1989, 38 (9), 1972-1974.
- T. Hayashi, M. Matsuo, US Pat. № 4001309, 1977.
- S.A. Postovoi, I.M. Vol’pin, E.I. Mysov, Yu.V. Zeifman, L.S. German, Russ. Chem. Bull., 1989, 38 (5), 1067-1070.
Материал рекомендован к публикации членом редколлегии С.Р. Стерлиным
Fluorine Notes, 2013, 87, 7-8


