Поступило в редакцию: июль 2012
УДК 547.16:678.074.6
Fluorine Notes, 2013, 87, 5-6
ВЛИЯНИЕ ДИМЕТИЛЕНОКСИДНОЙ ГРУППЫ В ПОЛИФТОРАЛКИЛПЕРОКСИДИКАРБОНАТАХ НА ИХ ДЕСТРУКЦИЮ
А.И.Рахимов, Л.А.Бутковская
Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация. Рассмотрено влияние диметиленоксидной группы на деструкцию ди (β- полифторалкоксиэтил)пероксидикарбонатов, [Н(CF2)nCH2OCH2 CH2OC(O)O]2, где n= 2,4 , в отсутствии растворителя и в среде бензола или этилбензола.
Ключевые слова: ди(β-полифторалкоксиэтил)пероксидикарбонаты, диметиленоксидная группа, β-полифторалкоксиэтилкарбонатные радикалы.
Ранее [1-5] показано, что полифторированные заместители в пероксидах оказывают значительное влияние на их индуцированный и мономолекуляр ный распад. Особое место среди пероксидикарбонатов занимают структур ные аналоги применяемого в промышленноси ди (β -н-бутоксиэтил)перокси дикарбоната - полифторалкилпероксидикарбонаты, которые содержат вместо н-бутокси-группы полифторалкильный заместитель.Эти пероксиды отлича ются от ранее изученных нами [6-9] наличием диметиленоксидной группы.
В данном сообщении рассмотрено влияние на индуцированный (в отсутствии растворителя) и мономолекулярный распад пероксидов в бензоле и этилбензоле введения диметиленоксидной группы между полифторалкиль ным фрагментом и пероксикарбонатной группой в ди (1.1.3-тригидро перфторпропил) пероксидикарбонате [HCF2CF2CH2OC(O)O]2 (I) и в ди (1.1.5-тригидроперфторпентил)пероксидикарбонате [H(CF2CF2)2CH2OC(O)O]2 (II) соответственно при переходе к ди [2- (1´.1´.3´-тригидроперфторпропокси) этил]пероксидикарбонату, [HCF2CF2 CH2OCH2CH2OC(O)O]2 (III) и к ди [2-(1´.1´.5´-тригидроперфторпентокси)этил]пероксидикарбонату, [H(CF2CF2)2 CH2OCH2CH2OC(O)O]2 (IV). Пероксидикарбонаты III, IV получены из промышленно доступных спиртов- теломеров (к тому же 1,1,5- тригидроперфторпентанол (V) является отходом производства 1,1,3-тригидро перфторпропанола (VI) [3]): при действии этиленхлоргидрина в щелочной среде синтезировали 2-(1´,1´,3´-тригидроперфторпропокси)этанол, HCF2CF2 CH2OCH2CH2OН (VII), 2(1´,1´,5´- тригидроперфторпентокси)этанол, [H(CF2CF2)2CH2OCH2CH2OН (VIII) [6, 10], затем спирты VII и VIII превращали в среде жидкого фосгена в соответствующие хлорформиаты и далее при действии пероксида натрия из хлорформиатов получали пероксидикарбонаты I – IV с выходом 78-86% (Таблица1) [7,8].
Таблица 1. Выход и свойства полифторалкил- и β –(полифторалкокси)этил пероксидикарбонатов
|
Пероксид |
Выход,% |
n20D |
d204 |
|
I II III IV |
78 80 86 85 |
1.3548 1.3362 1.3828 1.3630 |
1.6214 1.7167 1.4952 1.6138 |
Нами была изучена стабильность полифторированных пероксидикарбонатов в отсутствии растворителя, что особенно важно знать при хранении и применении пероксидов. Было установлено, что стабильность полифтори рованных пероксидикарбонатов значительно выше, чем для широко применяемого в промышленности ди (β -н-бутоксиэтил) пероксидикарбоната, [н-C4H9OCH2CH2OC(O)O]2, (IX) (Таблица 2). Для пероксида II при хранении его при 5°С в течение 180 суток не замечено разложения, а при нагревании этого пероксида в бензоле при 50°С период полураспада составляет 7.7 часов (Таблица 2). С уменьшением длины перфторированной цепочки при переходе от пероксида II к пероксиду I наблюдается незначительное повышение степени разложения (до 1% ). Введение диметиленоксидной цепочки между полифторалкильным фрагментом и пероксикарбонатной группой в пероксидикарбонате I при переходе к пероксидикарбонату III понижает стабильность пероксида при хранении: степень разложения при хранении в течение 180 суток увеличивается до 3%, а период полураспада уменьшается на 39% при нагревании этого пероксида при 50°С в бензоле . Сравнение показывает, что пероксидикарбонат III значительно стабильнее, чем ди (β -н-бутокси)этил пероксидикарбонат, который при температуре хранения 0°С распадается за 8 суток на 8%, а при 50°С в бензоле период полураспада составляет всего 1.1 часа.
Таблица 2. Влияние строения пероксидов и введения диметиленоксидной группы на их стабильность при хранении
|
Пероксид |
Стабильность при хранении |
Период полураспада 50 °С (бензол),час. |
||
|
Темп. хранения, °С |
Время хранения, суток |
Степень разложения, % |
||
|
I II III IX |
5 5 0-5 0 |
180 180 180 8 |
1 0 3 8 |
5.3 7.7 4.8 1.1 |
Результаты по стабильности пероксидов при хранении в интервале темпера тур 0-5 °С в основном отражают способность пероксидов к индуцированному распаду. В связи с этим необходимо было изучить термическое разложение полифторалкилпероксидикарбонатов в таких органических растворителях, как бензол и этилбензол при минимально низкой концентрации пероксида, дальнейшее уменьшение которой не влияет на скорость термолиза пероксида ( начальная концентрация пероксида не более (4-5)·10-2 моль/л) и в этих условиях обычно идет мономолекулярное разложение пероксида.
В таблице 3 показано влияние диметиленоксидной группы на константу скорости термического разложения полифторалкилпероксидикарбонатов I и II (термическое разложение этих двух пероксидов в бензоле и этилбензоле описано нами в сообщении [9] ). Введение в пероксид I диметиленоксидной группы приводит к увеличению скорости мономолекулярного распада пероксида III по О-О связи в бензоле в зависимости от температуры на 29-30% (50 и 60°С) и на 38% (70°С). Влияние диметиленоксидной группы на увеличение скорости мономолеку лярного распада для пероксида с удлиненной перфторированной цепочкой (пероксид IV) несколько больше, чем для пероксида III и составляет: 29.5% - 37.5% (50, 60°С) и 40% (70°С).
Термическое разложение пероксидов I- IV в этилбензоле существенно отличается от термолиза в бензоле: константы скорости мономолекулярного распада пероксидов без диметиленоксидной группы (I, II) близки и равны, k·10-4, с-1: 0.68-0.69 (50°С), 1.90-1.96 (60°С), 4.36-4,38 (70°С). Пероксиды III и IV с диметиленоксидной группой в структуре подвергаются термолизу в этилбензоле с меньшей скоростью, чем пероксиды I и II. При этом константы скорости термолиза пероксидов III и IV практически близки при температурах 50 и 60°С. Они равны (k·10-4, с-1): 0.36-0.39 (50°С),1.08(60°С), Это указывает на незначительное влияние длины перфторированной цепочки на процесс термолиза, определяемого в основном диметиленоксидной группой.
Полученные реультаты объсняются различиями в механизме процесса термического разложения пероксидов и в свойствах образующихся радика лов. Пероксиды I и II являются источником полифторалкоксильных радикалов, образующихся при β-распаде карбонатных радикалов
Полифторалкоксильные радикалы отрывают водород от CH2 -группы этилбензола, а образующиеся α- фенилэтильные радикалы участвуют в индуцированном распаде исходного пероксида [9].
Обнаруженное нами влияние диметиленоксидной группы на уменьшение константы скорости мономолекулярного распада полифторалкилперокси дикарбонатов III и IV в этилбензоле объясняется свойствами карбонатных радикалов с диметиленоксидной группой, образующихся при разложении этих пероксидов Эти карбонатные радикалы не склонны отрывать водород от CH2 -группы этилбензола, а вступают в реакции циклизации и конденсации аналогично β- (ацилокси)этилкарбонатным радикалам, образующихся при термолизе β- (ацилокси)этилпероксидикарбонатов [6] с образованием соединений А-С:
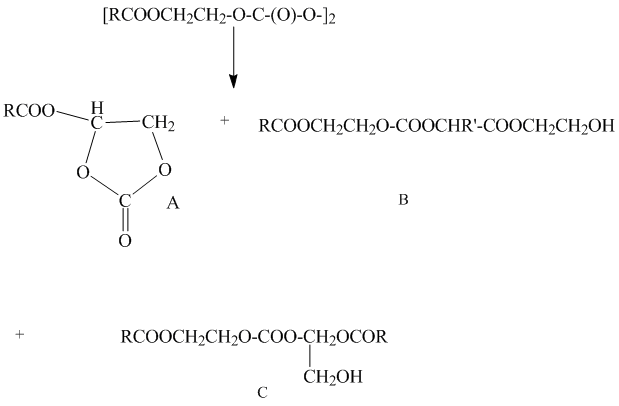
Заметное снижение скорости термолиза пероксидов III и IV в отличии от пероксидов I и II в этилбензоле указывает на малую вероятность образующихся первоначально при распаде пероксидикарбонатов карбонатных радикалов с диметиленоксидной группой участвовать в цепных радикальных реакциях.
Следует отметить, что, наблюдается отличие термолиза пероксидов III и IV при переходе от этилбензола к бензолу: константа скорости термолиза в бензоле значительно выше, чем в этилбензоле. Такое влияние на процесс термолиза природы растворителей можно объяснить разным характером распределения электронной плотности в этих углеводородах и и благодаря этому различиями во взаимодействии их с атомами фтора перфторированной цепочки молекулы пероксида. Природа таких взаимодействий рассмотрена в работах [11,12]. Так, теплоты адсорбции (q,кДж) составляют для ароматических углеводо родов и перфторалкильной группы: 33.4 –бензол и 43.5- этилбензол. Стандартные энтропии (-ΔS Дж/мол К) для указанных углеводородов и CF3- группы равны: 120-бензол и 135-этилбензол. Вероятно, что в условиях мономолекулярного распада пероксидикарбонатов по О-О-связи в «клетке» растворителя значительное влияние на термолиз оказывает полярность молекул растворителя и его адсорбционная способность, определяющая образование «клеточной» структуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ПМР регистрировали на приборе Varian Mercury 300 МГц. Внутренний стандарт – ГМДС. Растворитель – CCl4, CDCl4.
ИК-спектры снимали на приборе «Specord – M82» в тонком слое (жидкая пленка).
В ПМР-спектрах всех синтезированных пероксидикарбонатов сигнал концевого протона HCF2-группы представляет триплет триплетов с центром при 5.8±0.05 м. д. с константой спин-спинового взаимодействия от α-атомов JH-F=52 Гц, каждый из компонентов которого расщеплен в триплет с константой спин-спинового взаимодействия от β-атомов фтора JH-F=5.5 Гц.
Сигнал двух протонов метиленовой -СF2-CH2-группы виден в виде хорошо разрешенного триплета в области 4.6±0.03 м. д. с константой спин-спинового взаимодействия JH-F=5.5Гц.
В ИК-спектрах ди(полифторалкил)пероксидикарбонатов в области валентных колебаний групп >С=О наблюдается две полосы поглощения с частотами 1778±2 и 1807±3 см-1, что соответствует частотам валентных колебаний карбонильной группы в незамещенных пероксидикарбонатах [1, 3,8]. Это свидетельствует о том, что полифторалкильные группировки находясь в β-положении к пероксидикарбонатной группе не оказывают заметного влияния на спектральные характеристики. Валентные колебания О–О в ди(полифторалкил)пероксидикарбонатах проявляются в интервале 845–850 см-1. Валентные колебания пероксидной цепочки С–О–О–С наблюдаются в области 1041–1094 см-1, что соответствует литературным данным[3,8].
Ди[2-(1´.1´.3´-тригидроперфторпропокси)этил]пероксидикарбонат, [HCF2CF2 CH2OCH2CH2OC(O)O]2 III)
А. Синтез 2-(1´.1´.3´-тригидроперфторпропокси)этанола, HCF2CF2 CH2OCH2CH2OН
В реактор помещают 4.5 г ( 0.11 моль ) гидроксида натрия в виде 70%-ного водного раствора и последовательно дозируют 9.15 г( 0.11 моля ) 1.1.3-тригидроперфторпропанола и 9.15 г (0.11моля) этиленхлоргидрина. Реакционную массу нагревают до 70°С и перемешивают 4 часа. Раствор сушат сульфатом натрия и затем перегоняют в вакууме. Выход 2-(1´,1´,3´-тригидроперфторпропокси)этанола 73%. Т.кип. 50°С/1 мм., n20D 1.3613, d204 1.3678 ( аналогично получен 2-(1´,1´,5´-тригидроперфторпентокси)этанол с выходом 71%, Т.кип. 58-60°С/1 мм., n20D 1.3469, d204 1.5500),что соответствует литературным данным [10].
Б. Синтез 2-(1´.1´.3´-тригидроперфторпропокси)этилхлорформиата, HCF2CF2 CH2OCH2CH2OС(О)СI
Фосгенирование 2-(1´.1´.3´-тригидроперфторпропокси)этанола проводят по общепринятому методу [7,8,10]. Выход хлорформиата 93%. Т.кип. 56-57°С/1 мм, n20D 1.3821, d204 1.4420 ( аналогично получен 2-(1´,1´,5´-три гидроперфторпентокси) хлорформиат с выходом 78%, Т.кип. 70°С/1., n20D 1.3656, d204 1.5793).
В.Синтез 2-(1´.1´.3´-тригидроперфторпропокси)этилпероксидикарбоната, [HCF2CF2 CH2OCH2CH2OС(О)О]2
В трехгорлый реактор, снабженный мешалкой, термометром и капельной воронкой, помещают 2.25 г ( 0.056 моль ) гидроксида натрия в виде 17%-ного водного раствора при температуре 0 °С, дозируют 2.0 г 45%-ного раствора пероксида натрия Реакционную смесь перемешивают при указанной температуре в течение 20 мин., затем в реактор прикапывают раствор 13.07 г (0.056 моля) 2-(1´.1´.3´-тригидроперфторпропокси)этил хлорформиата в 15 мл абсолютного диэтилового эфира. Температуру реакционной массы повышают до 10°С и перемешивают 2 часа. Затем еще 1 час при 20°С. Органический слой отделяют, промывают водой до рН 6, сушат безводным сульфатом натрия, отделяют его, удаляют растворитель и примеси при вакууме 1 мм. рт.ст. в течении 40 мин. при 20°С. Выход 86%, n20D 1.3828, d204 1.4952 ( аналогично получен 2-(1´,1´,5´-три гидроперфтор пентокси) этилпероксидикарбонат с выходом 85%, , n20D 1.3630, d204 1.6138).
Кинетика термического разложения ди (полифторалкил)перокси дикарбонатов изучалась ампульным методом в бензоле и этилбензоле в атмосфере очищенного азота при температурах 50, 60 и 70°С в ультратермостате. Через определенные промежутки времени ампулы (объем 1 мл) извлекали (2 параллельных пробы), охлаждали и после вскрытия определяли количнство нераспавшегося пероксида методом иодометрического титрования [6].
Список литературы
- Rakhimov A.I. Initiators for Manufacture of PVC. New York. Nova Science Publishers Inc.. 2008. 182 p.
- Рахимов А.И. Методы микродопирования полифторированных фрагментов в макромолекулярные системы. Новые перспективные материалы и техноло гии их получения. НПМ-2010. Сборник научных трудов V Международной конференции. Волгоград. 2010. С.79-80.
- Рахимов А.И.. Химия и технология фторорганических соединений. М.: Химия.1986. 271 с..
- Рахимов А.И. Крюкова Е.Г. Богач Е.В., Сергеев С.А., Костыря В.И. Патент 2021286. Российская Федерация . МПК С 1 F 224 .114/08.1994.
- Рахимов А.И., Богданова О.С., Бутковская Л.А. Получение суспензионного поливинилхлорида в присутствии фторсодержащих пероксидикарбонатов. Химия и технология элементоорганических мономеров и полимерных материалов.. Сборник научных трудов Волгоградского государственного технического университета. Волгоград.1999. С.78-88.
- Рахимов А.И. Химия и технология органических перекисных соединений. М.: Химия.1979. 389с.
- Рахимов А.И., Бутковская Л.А. Бакланов А.В.. Синтез полифтор содержащих трет.-бутилпероксиалкилкарбонатов. Химия и технология элементорганических мономеров и полимерных материалов. Волгоград. 2008, т. 39, N. 1, с. 85.
- Рахимов А.И., Бутковская Л.А. Синтез и свойства ди(полифтор алкилпероксидикарбонатов. ЖОХ. 2011.т. 81. N 5. с.889.
- Рахимов А.И., Бутковская Л.А. Особенности термолиза ди(полфторалкилперокси)дикарбонатов // Fluorine notes: сетевой журнал 2012, N 3 (82), URL: /public/2012/3_2012/letters/rusletter5.html (дата обращения 15.01.2013).
- Синтезы фторорганических соединений./Под редакцией Кнунянца И.Л.и Якобсона Г.Г.- М.: Химия.1977.
- Рощина Т.М., Шония Н.К., Никольская А.Б.,Лагутова М.С.,ФадеевА.Ю. дсорбция гексана и бензола на фторированных кремнеземах: влияние длины перфторалкильной цепи. Физикохимия поверхности и защита материалов.2009.т.45. N2. с.165-171.
- Шония Н.К., Рощина Т.М., Никольская А.Б.,Лагутова М.С., Таякина О.Я.,Ткаченко О.П., Кустов Л.М., Фадеев А.Ю. Природа лиофобизующего покрытия и адсорбции органических молекул и воды на модифицированных кремнеземах. Ж.физ.химии. 2010, N11, 2131-2142
Материал рекомендован к публикации членом редколлегии проф. А.И. Рахимовым
Fluorine Notes, 2013, 87, 5-6


