Поступило в редакцию: март, 2012
УДК 661.185.2
Fluorine Notes, 2012, 81, 7-8
ЭТЕРИФИКАЦИЯ СПИРТОВ-ТЕЛОМЕРОВ (n= 3 и 4) АБИЕТИНОВОЙ КИСЛОТОЙ
Л.М.Попова1, С.В.Вершилов2
1Санкт-Петербургский государственный технологический университет растительных полимеров,
198095, Россия, Санкт - Петербург, улица Ивана Черных, дом 4
2ФГУП Научно-исследовательский
институт синтетического каучука им. акад.С.В. Лебедева, 198035, Россия, Санкт-Петербург,
ул. Гапсальская, д. 1
e-mail: lorapopova@mail.ru
Аннотация. Этерификацией 1Н,1Н,7Н-перфторгептан-1-ола и 1Н,1Н,9Н-перфторнонан-1-ола абиетиновой кислотой без растворителя в условиях кислотного катализа синтезированы новые полифторалкиловые эфиры.
Ключевые слова: Абиетиновая кислота; полифторалкилзамещеные абиетаты и дегидроабиетаты.
В настоящее время в связи с удорожанием углеводородов исследования по комплексной переработке растительного сырья получили дополнительный импульс. Так, перспективной для получения новых веществ является живичная и талловая канифоль как богатый источник трициклических карбоновых кислот.
Одним из способов модификации канифоли является ее этерификация, продукты которой, в зависимости от вида используемой канифоли и спирта, перспективны в производстве синтетических смол, сложноэфирных пластификаторов, термоплавких агентов липкости, лаков, красок, клеев для пищевой упаковки, удовлетворяющих новейшим экологическим требованиям [1,2] и проч. Принимая во внимание поверхностно-активные свойства соединений с длинноцепочечными фторалкильными группами [3], сложные эфиры канифоли и фторсодержащих спиртов могут являться ценными гидро- и олеофобизирующими агентами для волокнистых композиционных материалов.
Ранее нами был получен 1Н,1Н,5Н-тригидрооктафторпентилдегидроабиетат [4] путем этерификации 1Н,1Н,5Н-тригидрооктафторамилового спирта дегидроабиетиновой кислотой в присутствии H2SO4 конц. Кроме того, 2,2,2-трифторэтил-, 1Н,1Н,3Н-тригидротетрафторпропил-, 1Н,1Н,5Н-тригидро-октафторпентилабиетаты и – дегидроабиетаты; а также пентафторфенилабиетат и -дегидроабиетат синтезированы взаимодействием хлорангидрида абиетиновой кислоты и натриевых солей соответствующих фторсодержащих спиртов [5].
Аналогично проведенной этерификации талловой канифоли [6] нами синтезированы полифторалкилсодержащие эфиры (II и III) путем взаимодействия 1Н,1Н,7Н-додекафторгептан-1-ола и 1Н,1Н,9Н-гексадекафторнонан-1-ола с абиетиновой кислотой (I) по схеме:
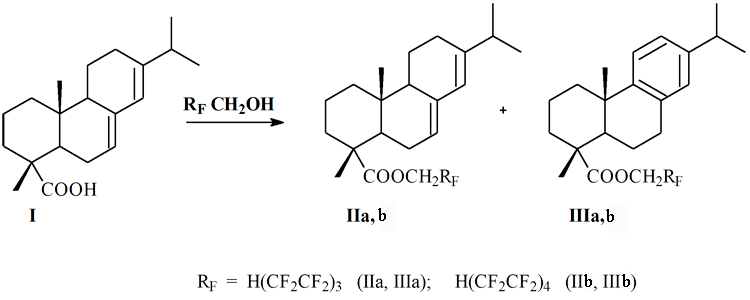
Реакцию этерификации проводили без растворителя в присутствии каталитических количеств концентрированной серной кислоты при эквимольном соотношении реагентов при 170-200°С в течение 5-6 ч. Контроль за ходом реакции осуществляли методом тонкослойной хроматографии (ТСХ). По окончании процесса реакционную массу растворяли в 50 мл диэтилового эфира и промывали 5%-ым раствором гидрокарбоната натрия и затем дистиллированной водой до нейтральной реакции, эфирный раствор сушили прокаленным сульфатом натрия, растворитель отгоняли. Образовались стеклообразные смолы, выходы продуктов составил около 90%.
Для доказательства состава и структуры полученных соединений были проведены аналитические и спектральные исследования.
В ИК спектрах продуктов (II и III) наблюдали полосы валентных колебаний С-Н связей в области 2997-2322 см-1, скелетные колебания ароматического кольца (νс=с, δсн) при 1488-1385 см-1, а также полосы валентных колебаний карбонильной группы С=О при 1749-1695 см-1, а интенсивные сигналы в интервале 1200-1134 см-1 соответствуют валентным колебаниям связи C-F (табл.).
Таблица. Аналитические и спектральные данные абиетиновой кислоты I и продуктов этерификации II и III.
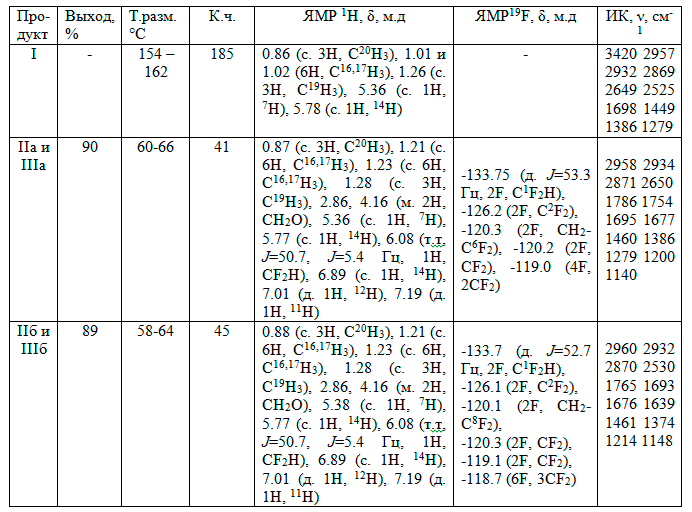
В спектрах ПМР соединений (II и III) наблюдается характерный сигнал протонов в виде мультиплета вместо ожидаемого триплета, что, вероятно, связано с образованием диастериомерных продуктов, группы –ОСН2– полифторалкилового фрагмента с химическими сдвигами 4.16 м.д. Сигналы олефиновых протонов наблюдали при 5.36 (IIб) и 5.38 (IIа) (С7Н) и 5.78 (С14Н) (II) м.д. О наличии в молекулах (III) ароматического кольца свидетельствуют сигналы протонов при 6.89 (С14Н) в виде синглета, а также два дублета при 7.01 (С12Н) и 7.19 (С11Н) м.д. Кроме того, в спектрах продуктов наблюдали сигналы метиновых протонов концевых групп –CF2H спиртов-теломеров в виде триплета триплетов с химическим сдвигом 6.08 м.д. (табл.). Если в исходной абиетиновой кислоте (I) по данным спектров содержалось около 10% дегидроабиетиновой кислоты, то по завершении процесса в образовавшихся эфирах (II и III) преобладали производные дегидроабиетиновой кислоты (III) (до 90%), аналогично [6, 7], когда имеет место диспропорционирование абиетиновой кислоты под действием концентрированной серной кислоты и температуры.
В спектрах ЯМР 19F синтезированных продуктов (II и III) резонансные сигналы фтора группы CF2H представлены дублетами с химическими сдвигами: –133.75 м.д. (JHF 53.3 Гц) (IIа и IIIа) и –133.7 (JHF 52.7 Гц) (IIб и IIIб). Сигналы атомов фтора метиленовой группы C2F2 проявляются в виде синглетов при –126.2 м.д. для (IIа и IIIа) и –126.1 м.д. для (IIб и IIIб); сигналы остальных атомов фтора CF2 групп наблюдаются в интервале –120.3 ÷ –118.7 м.д., их мультиплетность и интегральные интенсивности соответствуют полифторалкиловым фрагментам спиртов-теломеров (табл.).
Экспериментальная часть
Контроль за ходом реакции осуществляли методом ТСХ на пластинках Сорбфил, элюент: гексан–метиленхлорид–ацетон (1–1–0.5). ИК спектры регистрировали на приборе Shimadzu IRPrestige-2 (растворы в CCl4). Спектр ЯМР 1Н и 19F регистрировали на приборе Bruker 500 с рабочей частотой 500 МГц (470 МГц – для 19F), в растворе CDCl3, внешний стандарт – CCl3F.
В качестве исходных использованы спирты-теломеры (n = 3 и 4): 1H,1H,7H-перфторгептан-1-ол (а) и 1H,1H,9H-перфторнонан-1-ол (б).
1H,1Н,7Н-Додекафторгептилабиетат (IIа) и -дегидроабиетат (IIIа). К 5.0 г (17 ммоль) абиетиновой кислоты (I) при перемешивании добавляли 6,0 г (18 ммоль) 1Н,1Н,7Н-додекафторгептан-1-ола (IIа) и 2-3 капли конц. H2SO4 в токе аргона. По окончании добавления смесь выдерживали 5 ч при 170°С. Продукт экстрагировали диэтиловым эфиром (3 х 20 мл), экстракт промывали 5%-ым раствором соды и дистиллированной водой до нейтральной реакции, сушили прокаленным Na2SO4. Затем растворитель отгоняли, остаток выдерживали в вакууме над Р2О5. Выход 9.0 г (90%), светло-желтые аморфные кристаллы, т.разм. 60-66°С. Аналитические и спектральные данные представлены в табл.
1Н,1Н,9Н-Гексадекафторнонилабиетат (IIб) и – дегидроабиетат (IIIб). Синтез проводился аналогично соединению (IIIа) из 7,8 г (18 ммоль) 1H,1H,9H-гексадекафторнонан-1-ола (IIв) 6 ч при 200°С. Выход 10.5 г (89%), светло-желтые аморфные кристаллы, т.разм. 58-64°С. Аналитические и спектральные данные представлены в табл.
Выводы
При взаимодействии полифторалкиловых спиртов с абиетиновой кислотой без растворителя в присутствии каталитических количеств концентрированной серной кислоты при 170-200°С за 5-6 ч происходит диспропорционирование абиетиновой кислоты до дегидроабиетиновой и этерификацией последней с образованием соответствующих производных с выходами около 90%.
Список литературы
- Владимирова Т.М., Третьяков С.И., Жабин В.И., Коптелов А.Е. Получение и переработка талловых продуктов: моногр. Архангельск.: Изд-во Арханг. гос. техн. ун-та, 2008. 155 с.
- A.M. Al-Sabagh, T.T. Khidr, A.M. Atta // Petroleum Science and Technology. 2002. V. 20. N 7-8. P. 693-711.
- Исикава Н., Кобаяси Ё. Фтор. Химия и применение. М.: Мир, 1982. 276 с.
- Л.М. Попова, И.Н. Гайдуков // ЖПХ. 2008. Т. 81, № 2. С. 338–339.
- И.Н. Гайдуков, Л.М. Попова // ЖПХ. 2008. Т. 81, № 12. С. 2065–2067.
- Л.М.Попова, Ю.А.Дмитриева, С.В.Вершилов // ЖПХ. 2011. Т. 84. № 2. С. 329-332.
- Крячко Е.Н., Тришин Ю.Г., Попова Л.М. / Материалы V Всерос. науч. конф. «Химия и технология растительных веществ». Уфа, 8-12 июня 2008 г. С. 171.
Материал рекомендован к публикации членом редколлегии В.В. Корниловым
Fluorine Notes, 2012, 81, 7-8


