Поступило в редакцию: февраль 2012
УДК 547+541.138.2:547.221
Fluorine Notes, 2012, 81, 5-6
О МЕХАНИЗМЕ ЭЛЕКТРОХИМИЧЕСКОГО СИНТЕЗА ПЕРФТОРАЛКИЛБРОМИДОВ
О.Н.Чечина*, В.В.Беренблит**, С.В.Соколов***
*ФГБОУ ВПО Самарский Государственный Технический Университет
443100, г. Самара, ул. Молодогвардейская,
244,
e-mail: chechinao@yandex.ru
**ФГУП НИИСК им.С.В.Лебедева
198035, Санкт-Петербург, ул. Гапсальская, д. 1
***ЗАО "Анлес"
194044, Санкт-Петербург, Менделеевская, 2.
Аннотация. Методом поляризационных измерений и препаративного электролиза показана возможность получения перфторалкилбромидов электролизом растворов перфторкарбоновых кислот в водно-ацетонитрильной среде в присутствии бромида натрия на платиновом аноде за счет электрохимической десорбции абсорбированных атомов брома в процессе разряда перфторалкилкарбоксилатного аниона..
Ключевые слова: перфторалкилбромид, перфторкарбоновые кислоты, синтез Кольбе, бром, ацетонитрил, рентгеноконтрастное вещество, пламегаситель, препаративный электросинтез, электрохимическая десорбция, платиновый анод.
Перфторуглероды, содержащие в составе молекулы атомы брома, являются эффективными пламегасителями и используются для защиты персонала или ценного электронного оборудования при возгорании в замкнутых объемах [1]. Лабильность атома брома, как в радикальных, так в ионных реакциях, позволяет использовать его перфторалкильные соединения при синтезе новых фторорганических соединений. Перфтороктилбромид используют в качестве рентгеноконтрастного компонента газопереносящих жидкостей в медицине [2].
Описан ряд химических способов получения таких веществ. Эти способы требуют весьма жёстких условий и сложной аппаратуры и не обеспечивают необходимой чистоты и воспроизводимости свойств целевого продукта [3].
Для синтеза различных перфторированных соединений успешно используется электросинтез Кольбе [4-6], который не требует высоких температур и давлений и обеспечивает хорошую воспроизводимость результатов в мягких условиях электролиза. Известно, что при электролизе растворов частично нейтрализованных перфторкарбоновых кислот и галогена в среде смеси ацетонитрил-вода (1:1) реализуется электрохимческий вариант реакции Бородина-Хунсдикера с образованием соответствующих перфторалкилгалогенидов [7]. Использование перфторнонановой кислоты в присутствии элементного брома на платиновом анода при плотности тока 0,01-0,03 А/см2 позволило получить перфтороктилбромид с выходом до 94 %. [8].
В присутствии элементного хлора на поляризационной кривой на платине появляется волна окисления галогена, по крайней мере, на вольт предшествующая адсорбции и разряду перфторкарбоксилатного аниона [7]. Было высказано предположение, что адсорбция галогена с одной стороны и разряд анионов фторкарбоновых кислот – с другой, происходят на разных участках анодной поверхности, различающихся энергетическими характеристиками.
Анодная конденсация перфторалкильного радикала с радикалом брома на платиновом аноде, по-видимому, протекает по механизму электрохимической десорбции:
Br2сольв.+ Pt → (Pt)Br·адс (1)
(Pt)Br·адс + RFСОО· → RFBr + CO2 + e· (2)
Достаточно невысокая скорость процесса лимитируется низкой концентрацией свободных радикалов брома. Процесс сопровождается заметным выходом димера Кольбе за счет адсорбции перфторкарбоксилатных радикалов в условиях дефицита радикалов брома:
RFСОО·+Pt → (Pt)RFСОО·адс +e· (3)
(Pt)RFСОО·адс +RFСОО·→ RF-RF + 2СО2 +e· (4)
Поэтому мы попытались интенсифицировать электросинтез перфтороктилбромида в условиях анодного окисления перфторкарбоновой кислоты путём увеличения концентрации адсорбированных радикалов брома на поверхности анода при совместном разряде аниона перфторкарбоновой кислоты и неорганического бромид-иона. Адсорбция бром-радикала не является препятствием для разряда аниона фторкарбоновой кислоты. В условиях избытка адсорбированных радикалов брома на аноде реализуются оптимальные условия для их электрохимической десорбции. При этом в процессе разряда аниона перфторкарбоновой кислоты происходит конденсация радикалов брома с фторалкильным радикалом:
Br- → Br·адс + e· (5)
Br·адс + RfCOO· → RfBr + CO2 + e· (6)
Одновременно с реакцией (6) вероятна также с большим или меньшим выходом электрохимическая десорбция брома при димеризации его радикалов:
Br·адс + Br- → Br2 + e· (7)
Экспериментальная часть
В качестве электролитической среды для поляризационных измерений и препаративного электросинтеза использовали смеси ацетонитрила - (CH3CN по ТУ 6-09-3534-87), очищенного по методике [9], с дистиллированной водой в интервале концентраций от 90 до 30 % (об.).
Из перфторкарбоновых кислот использовали перфтороктановую (пеларгоновую) кислоту (СF3(СF2)7COOH)
фирмыAldrich ) и перфтор-2,5-диметил-3,6- диоксанонановую кислоту
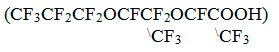 ,
,
полученную гидролизом тримера оксида гексафторпропилена производства
Кирово-Чепецкого химкомбината по ТУ 38.03.1.013. В качестве источника брома использовали
натрий бромистый марки "чда" по ГОСТ 4169-76. Для ГЖХ-анализа продуктов использовали хроматограф
ЛХМ-8МД - модель 5 с детектором по теплопроводности и программированеим температуры 30-200
оС (6 град/мин) с газом-носителем - гелием - 40 мл/мин на колонках Ø=
3 мм, l = 3 м с неподвижной фазой 15 % масс. СКТФТ-50 на твердом носителе Celite-545
(0,16-0,2 мм при плотности набивки 0,3г/см3).
Для ректификации продуктов использовали микроколонку Ø= 8 мм, l =100 мм с насадкой спиралей Левина 2х2 мм, при контролировании состава фракций ГЖХ.
Продукты электросинтеза идентифицировали по спектрам ЯМР 19F, снятых на спектрометре BrukerSpectrospin H-500 c частотой 470,6 МГц в растворе гексафторбензола с использованием дейтероацетона в качестве внутреннего стандарта.
Поляризационные измерения проводили в гальванодинамическом режиме по методике, описанной ранее [10], с использованием хлорсеребряного электрода сравнения.
Препаративный синтез перфтор-1-бромоктана
Электролизёр представлял собой цилиндрический сосуд вместимостью до 30 мл с магнитной мешалкой и змеевиком водяного охлаждения. На крышке электролизера укреплялись токоподводы электродов, термометр и газотводная трубка с обратным холодильником.
В качестве анода использовали платиновую пластину с рабочей поверхностью 4,4 см2, катодами служили две никелевые сетки с рабочей площадью 2,2 см2, размещенные с обеих сторон анода при межэлектродном расстоянии равном 1 см.
Электролит готовили, смешивая 3,09 г (0,03 моля) бромида натрия и 4,64 г (0,01 моля) перфторпеларгоновой кислоты с 50 % об. раствором ацетонитрила в воде и доводя объем электролита до 20 мл. Электролит расслаивался на два слоя: нижний водный слой представлял собой раствор бромида натрия, который высаливал перфторпеларгоновую кислоту, растворяющуюся в верхнем слое ацетонитрила.
При перемешивании слоев образовывалась эмульсия, электролиз которой вели с водяным охлаждением при температуре 25°C при анодной плотности тока 0,3 А/см2 силой тока 1,32 А до исчерпания перфторпеларгоновой кислоты, когда электролит через час, став нейтральным, гомогенизировался. Выделяющийся на аноде бром слегка окрашивал электролит. После окончания электролиза на дне электролизера в виде тяжелого фторорганического слоя отслаивался жидкий продукт, который отделяли, отмывали 5% Na2CO3, сушили над MgSO4 и ректификовали.
Выделили 4,40 г жидкого продукта с Ткип = 143°C. Спектр ЯМР 19F, приведенный в таблице 1, позволил идентифицировать его как перфтор-1-бромоктан с содержанием основного вещества 97 % масс. Примесь 3 % представляла собой продукт синтеза Кольбе - перфторгексадекан. Выход перфтор-1-бромоктана составил по веществу 91 % мол и по току 37 %.
Препаративный синтез перфтор-2-бром-2,5-диметил3,6-диоксанонана
В электролизёр загружали 20 мл аналогичным образом приготовленной смеси 4,96 г (0,01 моля) перфтор-2,5-диметил-3,6-диоксанонановой кислоты 3,09 г NaBr (1,5 г-моль/л) в 50 % об. растворе ацетонитрила в воде. Электролиз вели при перемешивании и температуре 25 оС, снизив анодную плотность тока до 0,2 А/см2, силой тока 0,88 А. Через час индукционного периода электросинтеза наблюдалось образование продукта, который каплями стекал с поверхности анода на дно электролизера, образуя третий, самый нижний слой. Еще через 40 минут электролиза электролит стал нейтральным и произошла гомогенизация его двух верхних слоев. Фторорганический нижний слой отделяли и обрабатывали аналогично вышеописанному. Получили 5,3 г практически чистого целевого перфтор-2-бром-2,5-диметил-3,6-диоксанонана с Ткип. = 139°C при 740 мм рт. ст., идентифицированного по спектру ЯМР 19F, приведенному в табл. 1. Содержание продукта димеризации по Кольбе не превышало 1 % масс. Выход перфтор-2-бром-2,5-диметил3,6-диоксанонана достигал 99 % мол по веществу и 36 % по току.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ
Поляризационные измерения
На рис. 1 приведены анодные поляризационные кривые платины в водно-ацетонитрильных 0,5 М растворах перфтор-2,5-диметил-3,6-диоксанонановой кислоты, снятые на фоне 1,5 М бромида натрия при различных соотношениях компонентов среды.
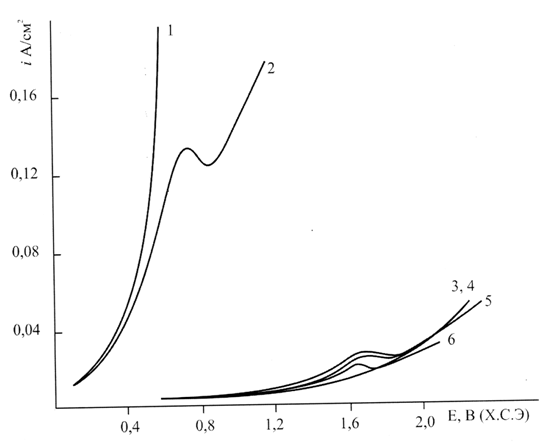
Рис. 1. Поляризационные кривые Pt-анода в смесях СН3CN:Н2О на
фоне 1,5 М:
1 - 30:70 % об.; 2 – 50:50 % об.; 3-6 в растворах 0,5 М |
3 -30:70 % об.; 5 – 50:50 % об.; 4 и 6 – 90:10 % об.; 6 - в отсутствие NaBr
На кривых 1 и 2, снятых в отсутствие перфторкарбоновой кислоты при содержании ацетонитрила в смеси с водой 30 и 50 % об. наблюдался быстрый рост поляризации, свидетельствующий о разряде брома в области потенциалов 0,6-0,8; их адсорбции на поверхности анода и десорбции в виде молекулярного дибромида.
В присутствии перфтор-2,5-диметил-3,6-диоксанонановой кислоты на кривых 3-5 при содержании ацетонитрила 30, 50 и 90 %об. наблюдалось существенное увеличение поляризации анода. Очевидно, это связано с вытеснением воды из двойного слоя анионами перфторкарбоновой кислоты и их последующим разрядом на занятой бром-радикалами поверхности анода и электрохимической десорбцией, приводящей к образованию перфтор-2-бром-5-метил-3,6-диоксанонана.
В отсутствие бромида натрия поляризационная кривая 6 отвечает электрохимической десорбции перфтордиоксаалкильных радикалов с образованием димеров, соответствующих синтезу Кольбе.
Поляризационные измерения, по крайней мере, не противоречат возможности разряда анионов перфторкарбоновых кислот на поверхности анода, покрытой адсорбированными радикалами брома.
Таким образом, адсорбция галоген-радикала, конкурируя с адсорбцией перфторкарбоксилатных и перфторалкильных радикалов, препятствует электрохимической десорбции перфторалкильных радикалов в синтезе Кольбе.
Препаративный электролиз
Ранее было показано [5,6], что оптимальный выход перфторполиэфиров при анодной конденсации перфтороксаалкилкарбоновых кислот по Кольбе достигается при объемном соотношении СН3СN:Н2О равном 90:10.
Для реализации вышеупомянутого конкурирующего процесса, приводящего к электросинтезу перфторалкилбромидов в качестве целевого продукта, необходимо было найти оптимальные условия препаративного электролиза, которые обеспечили бы увеличение концентрации адсорбированного галогена на аноде и снижение адсорбции перфторалкилкарбоксилатных радикалов на аноде.
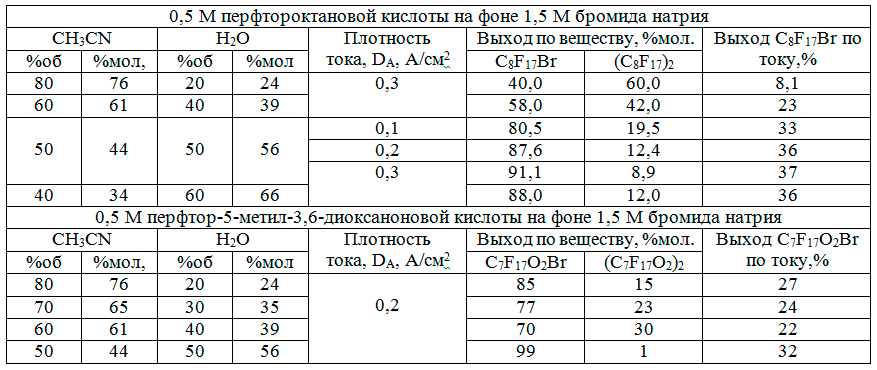
Была исследована зависимость выхода перфторалкилбромидов от плотности тока и состава водно-ацетонитрильных смесей в препаративных электролизах 0,5 М растворов перфторгексановой и перфтор-2,5-диметил-3,6-диоксанонановой кислот в присутствии 1,5 М бромида натрия на платиновом аноде с никелевым катодом. Результаты, приведены в таблице 2.
Очевидно, что максимальные выходы перфторалкилбромидов достигаются при соотношении объёмов ацетонитрила и воды существенно отличающемся от оптимального для реализации синтеза Кольбе 90:10. В данном случае оптимум находится вблизи равнообъемного соотношения 50:50, обеспечивая выходы перфторалкилбромидов выше 90 % мол., тогда как выходы продуктов димеризации в синтезе Кольбе не превышают 10 %мол.
Увеличение доли ацетонитрила в среде выше 50 % об. приводит к росту как растворимости перфторкарбоновых кислот в смеси, так и адсорбции их анионов на аноде при высокой анодной поляризации, обеспечивающей электросинтез Кольбе с ростом выхода димеров при 90 % об.CH3CN [5,6].
Сопоставление зависимости выходов по веществу и по току перфтор-2-бром-5-метил-3,6-диоксанонана от плотности тока и состава среды с поляризационными измерениями, по-видимому, подтверждают представления о том, что лимитирующей стадией процесса является адсорбция радикалов брома, образовавшихся в результате разряда бром-анионов при существенно более низких анодных потенциалах.
При снижении содержания ацетонитрила в среде ниже 40 % об. растворимость перфторкарбоновых кислот в смеси падает, что сопровождается мицеллообразованием. Это приводит к сильному вспениванию электролита, связанному с адсорбцией анионов кислоты, выступающих в качестве эмульгатора, на границе электролита и электролизных газов.
Высаливающее действие бромида натрия приводит к образованию эмульсии с формированием мицеллярных структур, содержащих ацетонитрил и перфторкарбоновую кислоту. Граница мицелл с водным раствором бромида натрия стабилизируется анионами перфторкарбоновых кислот.
Как следует из данных табл. 2 выход перфторалкилбромида при электролизе перфтор-2,5-диметил-3,6-диоксанонановой кислоты заметно выше и меньше зависит от соотношения ацетонитрил-вода, чем в случае перфторнонановой кислоты. Это может быть связано с затруднением адсорбции перфторкабоксилатного радикала из-за присутствия трифторметильной группы в -положении к карбоксильной группе. Вероятно, влияние также оказывает свободное вращение перфторалкильных фрагментов вокруг эфирных связей структуры. Всё это объясняет более плотную упаковку перфторалкильных радикалов при адсорбции на границе раздела фаз.
ВЫВОДЫ
- Препаративный электролиз растворов перфторкарбоновых кислот на Pt-аноде на фоне 1,5 М бромида натрия в среде смеси ацетонитрила с водой свидетельствует о возможности электросинтеза различных перфторалкилбромидов с выходом по веществу до 90 % мол.
- Поляризационные кривые, снятые на Pt-аноде в среде смеси ацетонитрила с водой на фоне 1,5 М бромида натрия с достаточно большой вероятностью подтверждают механизм электрохимической десорбции перфторалкилбромидов в результате разряда анионов перфторкарбоновых кислот на поверхности анода, занятой адсорбированными бром-радикалами.
Таблица 1. Спектры ЯМР19F перфторалкилбромидов.
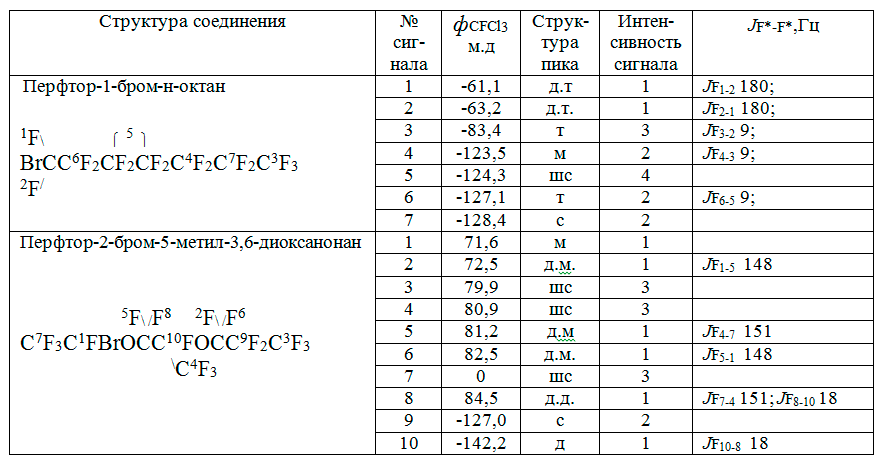
Таблица 2. Зависимость выходов продуктов от состава среды, плотности тока и структуры перфторкарбоновых кислот в препаративных электролизах на Pt-аноде 0,5 М растворов на фоне 1,5М NaBr.
Литература
- Б.Н.Максимов, В.Г.Барабанов и др. // "Промышленные фторорганические продукты". Справочник, 1996 г., "Химия", Санкт-Петербург, 554стр.
- MillerM.L., StinnetJ.D., Clark S.C. Ir. // J. Reticuliendothel. Soc., 1980, V. 27, P. 81-97.
- Г.Д.Орлов, В.А.Сараев // "Соединения фтора. Химия, технология, применение", Сбор. науч. тр. РНЦ "Прикладная химия", 2009 г., С.41.
- А.И.Левин, С.В.Соколов, О.Н.Чечина, К.Н.Бильдинов // ЖОХ, 1969, 39, 440
- N.V.Peganova, А.А.Ludiikainen, V.A.Matalin, T.V.Мikchailova, N.V.Puzanova, V.V.Loginova, G.I.Kaurova // Fluorine Notes Jurnal, 2009 N 6 (67)
- В.Ф.Черстков, В.А.Гринберг, С.Р.Стерлин, Ю.Б.Васильев, Л.С.Герман // Изв. АН СССР, сер. хим. 1990, N10, 2448
- В.А.Гринберг, В.Ф.Черстков, С.Р.Стерлин, Ю.В.Васильев, Л.С.Герман // Изв. АН СССР, сер. хим., 1990, N8, С. 1841
- Авт. свид. СССР N 1141706, 1984, МКИ "Способ получения перфтороктилборомида"
- "Органикум". Практикум по органической химии, 1979, "Мир", Москва, Т. 2, С. 356.
- Чечина О.Н., Беренблит В.В., Левин А.И. // ЖПХ, 1999, Т.72, Вып. 3, С. 410-415.
Материал рекомендован к публикации членом редколлегии А.Я. Запеваловым
Fluorine Notes, 2012, 81, 5-6


