Поступило в редакцию: февраль 2012
УДК 547.831 + 547.556.8
Fluorine Notes, 2012, 81, 3-4
Взаимодействие 2-замещенных 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот с пентафторфенилгидразином. Синтез 5-замещенных 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-онов
Д А. Руденко, В.И. Карманов1, П.Т. Павлов, М.И. Вахрин, С.Н. Шуров, Л.Н. Баженова2
ГОУ ВПО "Пермский государственный национальный исследовательский университет",
614990, Пермь,
ул. Букирева 15, тел.: +7(342)239-66-12
e-mail: seshurov@yandex.ru
1Институт технической химии УрО РАН, 614013, Пермь, ул. Академика Королева,
3
2Институт органического синтеза им. И. Я. Постовского УрО РАН, 620041, Екатеринбург,
ул.С.Ковалевской, 22 / Академическая, 20
Аннотация. Показано, что при взаимодействии 2-замещенных 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот и пентафторфенилгидразина, взятых в эквимолярных количествах, образуются соответствующие 5-замещенные 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-оны. Строение полученных соединений подтверждено данными ЯМР 1Н и 19F спектроскопии.
Ключевые слова: 2-замещенные 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновые кислоты, пентафторфенилгидразин, 5-замещенные 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-оны.
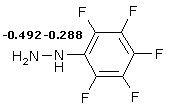
Известно, что эфиры 2-замещенных 5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот реагируют с гидразином с образованием 5-замещенных 3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-онов [1]. Аналогичные результаты были получены при исследовании взаимодействия 2-замещенных 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот с гидразином, а также его этил- и фенил- производными [2]. Формирование пиридазинового фрагмента объясняется участием в реакции обоих атомов азота молекул гидразина и его монопроизводных. Пентафторфенилгидразин в подобных реакциях исследован не был. Интерес к этому соединению обусловлен тем, что нуклеофильность атомов азота N1 и N2 в молекуле существенно отличается, и, вероятнее всего, во взаимодействии может участвовать только атом азота N2. Этот вывод сделан на основании проведенного неэмпирического квантово-химического расчета полных зарядов атомов азота по Левдину молекулы пентафторфенилгидразина.
Установлено, что в результате взаимодействия 2-замещенных 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот 1a-i и пентафторфенилгидразина (2), взятых в эквимолярных количествах, с хорошими выходами образуются соответствующие 5-замещенные 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-оны 5a-i.
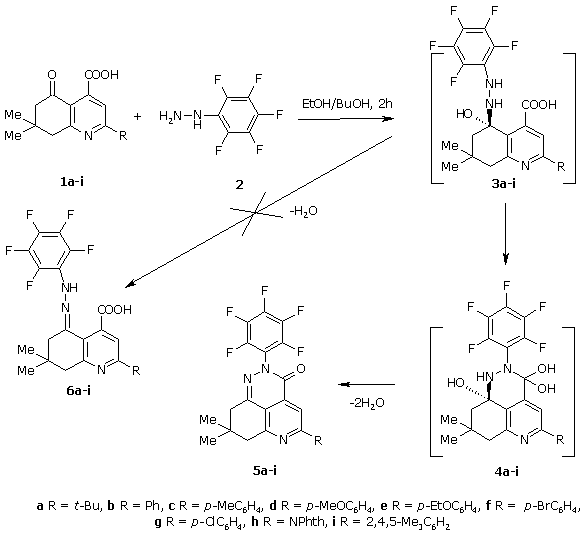
Полученные пиридо[4,3,2-de]циннолин-3-оны 5a-i представляют собой бесцветные кристаллические вещества. Выходы, температуры плавления и данные элементного анализа синтезированных соединений представлены в таблице 1.
Таблица 1. Выходы, температуры плавления и данные элементного анализа соединений 5a-i.
| Соединение | Брутто-формула | Найдено, % Вычислено, % |
Т. пл., °С (раств.) |
Выход, % | |||
| С | H | N | F | ||||
| 5a |
C22H20F5N3O |
60.41 60.41 |
4.52 4.61 |
9.47 |
21.47 21.82 |
98-99 (EtOH) |
75 |
| 5b |
C24H16F5N3O |
62.87 63.02 |
3.60 3.53 |
9.16 9.19 |
20.77 20.77 |
174-175 (BuOH) |
72 |
| 5c |
C25H18F5N3O |
63.92 63.69 |
3.81 3.85 |
8.91 8.91 |
20.08 20.15 |
195-196 (BuOH) |
72 |
| 5d |
C25H18F5N3O |
61.59 61.60 |
3.50 3.72 |
8.58 8.62 |
19.50 19.49 |
174-175 (EtOH) |
83 |
| 5e |
C26H20F5N3O2 |
62.46 62.28 |
3.89 4.02 |
8.48 8.38 |
18.85 18.94 |
133-134 (EtOH) |
68 |
| 5f |
C24H15BrF5N3O |
53.77 53.75 |
2.88 2.82 |
7.77 7.84 |
17.67 17.71 |
211-212 (BuOH) |
69 |
| 5g |
C24H15ClF5N3O |
58.74 58.61 |
3.26 3.07 |
8.54 8.54 |
19.61 19.31 |
194-195 (BuOH) |
67 |
| 5h |
C28H18F5N3O |
66.41 66.27 |
3.61 3.58 |
8.28 8.28 |
18.75 18.72 |
163-164 (BuOH) |
63 |
| 5i |
C27H22F5N3O |
65.03 64.93 |
4.28 4.44 |
8.34 8.41 |
19.03 19.02 |
192-193 (BuOH) |
85 |
Схема образования соединений 5a-i включает присоединение молекулы пентафторфенилгидразина (2) к атому углерода С5 исходной кислоты 1a-i и циклизацию образующегося интермедиата 3a-i за счет внутримолекулярной нуклеофильной атаки атома азота, связанного с пентафторфенильным радикалом, атома углерода карбоксильной группы. Отщепление двух молекул воды от интермедиата 4a-i дает продукт реакции 5a-i. По-видимому, внутримолекулярная нуклеофильная атака (интермедиат 3a-i) более благоприятна, по сравнению с возможной дегидратацией с образованием соответствующих пентафторфенилгидразонов 6a-i.
Строение продуктов реакции подтверждено данными ИК и ЯМР 1Н и 19F спектроскопии (таблица 2). Так, в ИК спектрах соединений 5a-i присутствует характеристическая полоса валентных колебаний связи С3=О в области 1681-1695 см-1, а также полоса валентных колебаний связи C-F в области 993-1005 см-1 и интенсивная полоса в области 1586-1596 см-1, которую можно отнести к валентным колебаниям связей С=N и C=C. В ЯМР 1Н спектрах присутствуют сигналы метильных протонов в области 1.14-1.21 м.д., метиленовых протонов С7Н2 и С9Н2 в области 3.03-3.17 и 2.82-2.91 м.д., соответственно, и протона С4Н в слабом поле 7.64-8.44 м.д., а также сигналы протонов заместителей R.
Таблица 2. ИК и ЯМР 1Н спектры соединений 5a-i .
| Соединение | ИК спектр, ν, см-1 | Спектр ЯМР 1Н, δ, м.д. (J, Гц) | ||||||
С=С + C=N |
C3=O |
С–F |
6H, 2CH3 (c) |
2H, C7H2 (c) |
2H, C9H2 (c) |
1H, C4H (c) |
Сигналы R |
|
| 5a | 1596 | 1687 | 998 | 1.14 | 3.09 | 2.82 | 7.97 | 1.44 (9Н, c, C(CH3)3) |
| 5b | 1591 | 1681 | 993 | 1.17 | 3.17 | 2.85 | 8.43 | 7.49-7.59 (3Н, м, C6H5) 8.27-8.30 (2Н, м, C6H5) |
| 5c | 1587 | 1688 | 1002 | 1.17 | 3.16 | 2.84 | 8.41 | 2.41 (3Н, с, CH3) 7.37 (2Н, д, J = 8.0, H Ar) 8.20 (2Н, д, J = 8.0, H Ar) |
| 5d | 1591 | 1684 | 1003 | 1.17 | 3.13 | 2.83 | 8.35 | 3.89 (3Н, с, ОСН3) 7.10 (2Н, д, J = 9.0, H Ar) 8.27 (2Н, д, J = 9.0, H Ar) |
| 5e | 1586 | 1689 | 1003 | 1.17 | 3.13 | 2.82 | 8.35 | 1.40 (3Н, т, J = 7.0, ОСН2СН3) 4.15 (2Н, к, J = 7.0, ОСН2СН3) 7.08 (2Н, д, J = 9.0, H Ar) 8.26 (2Н, д, J = 9.0, H Ar) |
| 5f | 1596 | 1688 | 1004 | 1.17 | 3.17 | 2.85 | 8.44 | 7.72 (2Н, д, J = 9.0, H Ar) 8.25 (2Н, д, J = 9.0, H Ar) |
| 5g | 1598 | 1687 | 1005 | 1.17 | 3.16 | 2.85 | 8.43 | 7.57 (2Н, д, J = 9.0, H Ar) 8.31 (2Н, д, J = 9.0, H Ar) |
| 5h | 1592 | 1689 | 999 | 1.21 | 3.03 | 2.91 | 7.64 | 7.82-7.50 (4Н, м, С10Н7) 8.23-8.02 (3Н, м, С10Н7) |
| 5i | 1596 | 1695 | 998 | 1.17 | 3.14 | 2.86 | 8.05 | 2.29 (6H, c, 2CH3) 2.39 (3H, c, CH3) 7.11 (1H, c, C6H2(СН3)3) 7.37 (1H, c, C6H2(СН3)3) |
В спектрах ЯМР 19F присутствуют характерные сигналы пентафторфенильной группы (таблица 3).
Таблица 3. ЯМР 19F спектры соединений 5a-i.
|
Соединение |
Спектр ЯМР 1Н, δ, м.д. (J, Гц) |
||
|
Fp (т) |
Fo (д) |
Fm (гр. с) |
|
|
5a |
-78.36 |
-70.08 |
-87.35 |
|
5b |
-78.28 |
-69.86 |
-87.25 |
|
5c |
-78.32 |
-69.91 |
-87.28 |
|
5d |
-78.39 |
-69.90 |
-87.32 |
|
5e |
-78.39 |
-69.88 |
-87.31 |
|
5f |
-78.20 |
-69.81 |
-87.22 |
|
5g |
-78.21 |
-69.80 |
-87.22 |
|
5h |
-78.63 |
-70.34 |
-87.67 |
|
5i |
-74.54 |
-67.80 |
-83.91 |
Таким образом, на основе взаимодействия 2-замещенных 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот с пентафторфенилгидразином разработан эффективный способ получения 5-замещенных 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-онов. Показано, что природа радикала в положении 2 исходных кислот не оказывает существенного влияния на выход целевых продуктов.
Экспериментальная часть
ИК спектры соединений 5a-i сняты на ИК-Фурье спектрометре IFS 66ps "Bruker" (в суспензии вазелинового масла). Спектры
ЯМР 1Н и 19F записаны на приборе Varian MERCURY+300 при 300 МГц
и 282 МГц соответственно в растворах ацетона-d6, внутренние
стандарты – ГМДС (δ = 0.059 м. д.) и трифторуксусная кислота (δ = 0.00 м. д.). Элементный
анализ выполнен с использованием аттестованных методик измерений:
МВИ 88–16358–124–2011
"Методика измерений массовой доли углерода, водорода и азота в органических соединениях»
на автоматическом анализаторе "CHN" РЕ-2400, с.II (PerkinElmerInstruments,
США) и МВИ 88–16358–95–2009 "Определение массовой доли фтора в органических соединениях
спектрофотометрическим методом". Данные исследования проводились на спектрофотометре
"Specord 200" PC ("Analitic Jena AG" Германия).
Квантово-химические расчеты выполнены с помощью пакета программ Firefly [3] на персональном компьютере Toshiba 400 PORTEGE.
5-Замещенные 8,8-диметил-2-пентафторфенил-3,7,8,9-тетрагидро-2Н-пиридо[4,3,2-de]циннолин-3-оны 5a-i (общая методика). Смесь 3 ммоль соответствующей 2-замещенной 7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновой кислоты 1a-i и 3 ммоль (0.6 г) пентафторфенилгидразина (2) кипятят в 30 мл бутилового или этилового спирта в течение 2 ч. Реакционную смесь охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из этилового или бутилового спирта.
Список литературы
- Mulamba T., El Boukili-Garre R., Seraphin D., Noe E., Charlet-Fagnere C., Henin J., Laronze J., Sapi J., Barret R., Laronze J-Y., Levy J. Synthesis of compounds with the novel 2,3,7-triazaphenalene ring system // Heterocycles. 1995. Vol. 41. N 1. Р. 29-36. .
- Шуров С. Н., Руденко Д. А., Карманов В. И., Наймушина Я. А. Взаимодействие 2-арил-7,7-диметил-5-оксо-5,6,7,8-тетрагидрохинолин-4-карбоновых кислот с гидразинами. Синтез 5-арил-8,8-диметил-8,9-дигидро-2Н-пиридо[4,3,2-de]циннолин-3(7Н)-онов. Сб. тез. докл. III Международной конференции «Химия гетероциклических соединений», посвященная 95-летию со дня рождения профессора А. Н. Коста. Москва, 2010. С. 175.
- Granovsky А. А. Firefly version 7.1.G. URL: http://classic.chem.msu.su/gran/firefly/index.html (дата обращения: 02.11.2011).
Материал рекомендован к публикации членом редколлегии д.х.н. А.Я. Запеваловым
Fluorine Notes, 2012, 81, 3-4


