Поступило в редакцию: Июль, 2011
УДК 547.221
Fluorine Notes, 2011, 77, 5-6
ПОЛУЧЕНИЕ ФТОРАЛИФАТИЧЕСКИХ СУЛЬФОХЛОРПРОИЗВОДНЫХ МЕТОДОМ ФОТОХИМИЧЕСКОГО СУЛЬФОХЛОРИРОВАНИЯ
О.С. Андриенко 1,2, В.В. Жук1, Т.Д.Малиновская1, Н.Ф. Мингалимов1, В.И.Сачков1,3, В.А. Яновский1
1)Обособленное структурное подразделение "Сибирский физико-технический институт имени
академика В.Д.Кузнецова" Томского государственного университета, 634050, Россия, г. Томск,
пл. Новособорная, 1, тел. (3822)413799, e-mail: itc@spti.tsu.ru
2) Учреждение Российской академии наук Институт оптики атмосферы имени В.Е.
Зуева Сибирского отделения РАН, 634021, Россия, г. Томск, пл. Академика Зуева, 1
3) Учреждение Российской академии наук Институт проблем химико-энергетических технологий Сибирского
отделения РАН, 659322, Россия, Алтайский край, г. Бийск, ул. Социалистическая, 1
Аннотация. В работе представлено исследование процесса получения фторалифатических сульфохлопроизводных методом фотохимического сульфохлорирования. Найдены оптимальные условия синтеза и изучена реакция взаимодействия дифторметана, Cl2 и SO2.
Ключевые слова: фторалифатические сульфокислоты, сульфохлорирование, фторалкансульфохлориды.
Фторированные алифатические сульфокислоты и их производные находят широкое применение в синтезе лекарственных веществ, пестицидов, в качестве кислотных катализаторов различных органических реакций, как биологически активные вещества [1, 2], а также в сельском хозяйстве [3]. Однако существующие в настоящее время методы синтеза этих соединений обладают рядом существенных недостатков таких как: низкие выходы, жесткие условия синтеза и сложность выделения, что обуславливает высокую стоимость данных продуктов на мировом рынке и значительно ограничивает их производство. Так, например, наиболее разработанным способом получения дифторметансульфокислоты, на сегодняшний день, является сульфирование дифторхлорметана сульфитом натрия. Реакция проводится в автоклаве в течение 20 часов при температуре 120-150°С и давлении 80-150 атм., при этом выход целевого продукта обеспечивается на уровне не более 50% [2].
Таким образом, поиск принципиально новых путей синтеза фторированных алифатических сульфокислот является актуальной научно-технической задачей.
Нами впервые было осуществлено сульфохлорирование фторалифатических углеводородов.
Цель данной работы заключается в разработке нового способа синтеза фторалкансульфохлоридов из фторалканов, хлора и сернистого ангидрида.
Реакция проводилась в проточном кварцевом фотохимическом реакторе, оснащенном рубашкой. Реакцию сульфохлорирования проводили как в газовой, так и в жидкой фазе, при этом в качестве растворителя использовался четырёхлористый углерод. Температура варьировалась от -20 до +50°С. Под действием УФ-излучения происходит радикальная реакция взаимодействия дифторметана, Cl2 и SO2. В качестве источника УФ-излучения использовали УФ-лампы с (λ=254 нм, λ=310 нм).
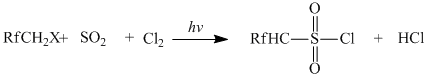
где Rf = F, CF3, C2F5; X = H, F).
Результаты опытов получения фторалкансульфохлоридов представлены в таблице 1.
Таблица 1. Условия и выход реакции прямого фотохимического сульфохлорирования алифатических углеводородов.
|
# |
Исходный фторалкан |
Состав реакционной смеси, моль на 1 моль фторалкана |
Т, °С |
Выход, % |
||
|
Rf |
X |
Cl2 |
SO2 |
|||
|
1 |
F |
F |
0.5 |
1.5 |
25 |
46 |
|
2 |
F |
F |
1 |
1.5 |
25 |
44 |
|
3 |
F |
F |
1 |
2 |
25 |
40 |
|
4 |
F |
F |
1 |
3 |
25 |
42 |
|
5 |
F |
F |
1 |
1.5 |
0 |
36 |
|
6 |
F |
F |
1 |
1.5 |
40 |
31 |
|
7 |
F |
H |
1 |
1.5 |
25 |
60 |
|
8 |
CF3 |
F |
1 |
1.5 |
25 |
43 |
|
9 |
CF3 |
H |
1 |
1.5 |
25 |
51 |
|
10 |
CF3 |
H |
0.75 |
2 |
25 |
55 |
|
11 |
CF3CF2 |
H |
0.75 |
1.5 |
25 |
45 |
|
12 |
CF3CF2 |
H |
1 |
1.5 |
25 |
43 |
|
13 |
CF3CF2CF2 |
H |
1 |
1.5 |
25 |
30 |
|
14 |
CF3(CF2)6 |
H |
1 |
1.5 |
25 |
24 |
Как видно из результатов приведённых в таблице 1, наиболее эффективным является проведение реакции при комнатной температуре и соотношении реагентов: фторуглеводород: Cl2:SO2=1:1:1.5.
Предложен новый метод синтеза фторалкансульфохлоридов. Структуры всех полученных соединений доказаны с помощью спектроскопии ЯМР 1Н и 13С, ИК-спектроскопии и масс-спектрометрии.
Работа поддержана грантом министерства образования и науки РФ АВЦП 2.1.1/2430 и ФЦП "Научные и научно-педагогические кадры инновационной России" на 2009-2013 годы (Проекты 02.740.11.0257 и П74).
Список литературы
- Filler R., Kobayashi Y., Yagupolskii Y. L. Organofluorine Compounds in Medicinal Chemistry and Biological Applications. – Amsterdam: Elsevier, 1993.
- Ojima I., McCarthy J. R., Welch J. T. Biomedical Frontiers of Fluorine Chemistry. – Washington, DC: Eds, 1996.
- Banks R. E. Fluorine in Agriculture. – Sale, Cheshire, U.K: Fluorine Technology Limited, 1995.
Материал рекомендован к публикации членом редколлегии С.М. Игумновым
Fluorine Notes, 2011, 77, 5-6


