Поступило в редакцию: март, 2011
УДК 546.16
Fluorine Notes, 2011, 77, 3-4
ВЛИЯНИЕ ПОЛИФТОРАЛКИЛЬНЫХ ГРУПП В СОПОЛИМЕРЕ АКРИЛАМИД-АКРИЛАТ НАТРИЯ НА СВОЙСТВА ЕГО НИЗКОКОНЦЕНТРИРОВАННЫХ ВОДНЫХ РАСТВОРОВ
Рахимов А.И., Вершинин Д.А., Мирошниченко А.В., Рахимова О.С.
Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация. Установлено, что в низкоконцентрированных водных растворах полифторалкилированного сополимера акриламида-акрилата натрия в 5.9 раз для 0.1 % раствора и в 5.2 раза для 0.3 % раствора уменьшается условная вязкость, а температура замерзания раствора снижается до минус 20 оС. Это позволяет рекомендовать для использования низкоконцентрированные водные растворы полифторированных сополимеров в различных областях техники.
Ключевые слова: Полифторалкилхлорсульфиты, сополимер акриламида-акрилата натрия, полифторалкиловый эфир, ацетат натрия
Ранее [1-3] было установлено, что полифторалкилхлорсульфиты являются уникальными полифторалкилирующими реагентами, действие которых на соли карбоновых кислот приводит к получению сложных эфиров полифторированных спиртов.
В данной работе (на примере 1,1,5-тригидроперфторпентилхлорсульфита) показано, что указанная реакция может использоваться для введения полифторалкильной группы в сополимер акриламид-акрилата натрия:
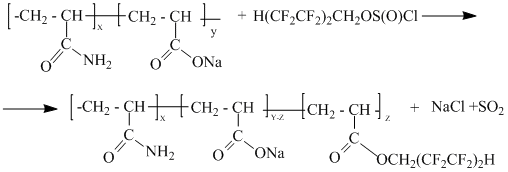
Полифторалкилирование натракрилатных групп в сополимере проведено 1,1,5-тригидроперфторпентилхлорсульфитом по методам, описанным в работах [2,3].
Молекулярная масса исходного сополимера составляет 1.2·106, а соотношение звеньев в макромолекулярной цепи определено, как 60 % акриламидных и 40 % натркарбоксилатных.
Методом прямой потенциометрии с фторселективным электродом определено содержание фтора в образце (после его сгорания и титрования), которое составило 3.7 % (масс). В ИК-спектре полифторалкилированного сополимера в отличие от исходного сополимера присутствует интенсивная полоса поглощения 1760 см-1. Это указывает на то, что реакция 1,1,5-тригидроперфторпентилхлорсульфита с натркарбоксилатной группой сополимера протекает по аналогии с натриевыми солями монокарбоновых кислот [2] и натриевыми солями олигомеров ε-аминокапроновой кислоты [3].
Содержание фтора, рассчитанное на один октафторпентильный фрагмент, введенный в сополимер, составляет 0.013 % (масс.). Следовательно, ориентировочно в реакции полифторалкилирования приняло участие 6.6 % (масс.) натркарбоксилатных групп, что соответствует z≈300.
Измерение условной вязкости водных растворов сополимера проводилось на трехрожковом капиллярном стеклянном вискозиметре (ВПЖ-1) при температуре 22 °С, объеме анализируемого раствора 25 мл, диаметре капилляра 1.52 мм. Концентрация водных растворов сополимеров составила 0.1 и 0.3 % масс (таблица 1).
Таблица 1. Влияние концентрации водных растворов сополимера и его полифторалкильного производного на вязкость
|
Концентрация, % |
Условная вязкость, сек. |
|
|
исходный олигомер |
полифторалкилированный олигомер |
|
|
0.3 |
83 |
16 |
|
0.1 |
59 |
10 |
|
вода |
4 |
|
Как видно из таблицы 1, условная вязкость 0.1 %-ного водного раствора с полифторированными фрагментами сополимера снижается в 5.9 раза, а для 0.3 %-ного водного раствора в 5.2 раза. Очевидно, что введение в макромолекулу сополимера полифторалкильных групп оказывает существенное влияние на структуру кластеров воды по сравнению с нефторированным сополимером [4]. Это можно объяснить тем, что введение в макромолекулу сополимера примерно трёхсот Н(CF2CF2)2CH2-фрагментов, обладающих гидрофобными свойствами, приводит к снижению молекулярной массы кластерных структур, образующихся с участием функциональных групп сополимера.
Важнейшим свойством водных растворов является их температура замерзания. В связи с этим нами проведено сравнение влияния ацетатных групп на примере ацетата натрия (в последнее время широко используемого как антигололёдное средство) и исследуемых сополимеров с хлоридами натрия и кальция. В таблице 2 приведены температуры замерзания водных растворов указанных солей и сополимеров.
Таблица 2. Влияние состава водных растворов на температуру замерзания
|
Водный раствор |
Концентрация, % (масс.) |
Температура замерзания, °С |
|
хлорид натрия |
8 |
-4 |
|
26 |
-10 |
|
|
хлорид аммония |
23 |
-5 |
|
гексагидрат хлорида кальция |
70 |
-12 |
|
формиат натрия |
4 |
-8 |
|
8 |
-10 |
|
|
тригидрат ацетата натрия |
4 |
-7 |
|
8 |
-10 |
|
|
16 |
-10 |
|
|
Сополимер акриламида-акрилата натрия |
0.1 |
-18 |
|
Полифторалкильное производное сополимера |
0.1 |
-20 |
Как видно из таблицы 2, наибольшим эффектом снижения температуры замерзания при низких концентрациях обладает ацетат и формиат натрия, а наличие большого числа натркарбоксилатных групп в макромолекуле сополимера существенно усиливает эффект – температура замерзания снижается до минус 18°С. Введение полифторалкильных групп незначительно влияет на снижение температуры замерзания водного раствора (минус 20°С).
Нами для оценки влияния натркарбоксилатных групп, в сравнении с хлоридами металлов проведён анализ возможных кластерных структур, образующихся с учётом этих групп.
Для этого квантово-химическим методом ab-initio в базисе 6-31G проведен анализ электронного строения димеров и тетрамеров воды, ацетата, формиата и хлорида натрия, а также ассоциатов ацетата, формиата и хлорида натрия с димером воды, которые могут образовываться при взаимодействии солей с кластерами воды.
Неэмпирический метод позволяет учесть все взаимодействия между электронами и ядрами в молекулах. Анализ электронного и геометрического строения комплексов на основе ацетата и формиата натрия с димером воды показал, что структуры комплексов идентичны.
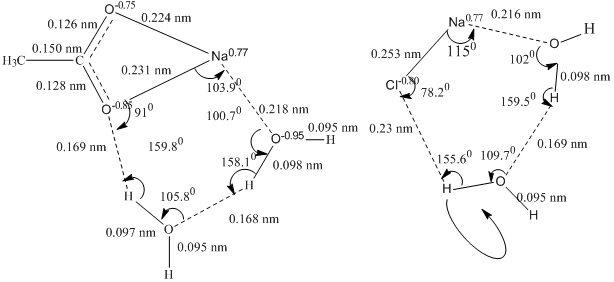
Рис. 1. Комплекс ацетата и хлорида натрия с двумя молекулами воды
В ассоциатах натриевых солей с димером воды (элементарным звеном кластера) образуется шестичленная структура между контактной ионной парой молекулы натриевой соли и димером воды (рисунок 1). Проведено сравнение зарядов на атомах, длин связей, валентных углов, барьеров вращения атомов водорода вокруг связей в исходных димерах и комплексах, а также определены полные энергии для процессов образования комплексов из исходных структур.
В комплексах наблюдается удлинение валентных HO-связей по сравнению со свободным димером от 0.096 нм до 0.098 нм. Валентный угол в димере равен 180°, а в структуре с NaCl и солями карбоновых кислот он уменьшается соответственно до 159.5° и 158.1°.
Изменения зарядов на атомах водорода и кислорода обеих молекул воды в структуре комплекса несут важную информацию о процессах поляризации связей, приводящих к изменению валентных углов димера. В натрхлоридном комплексе положительно заряженный натрий взаимодействует с атомом кислорода димера, что приводит к понижению отрицательного заряда на атоме кислорода до -0.95 (в свободном димере был -0.88). При этом валентная НО-связь поляризуется. В результате кислород, удаленный на водородную связь также становится более отрицательным (заряд понижается от -0.83 до -0.91). Атомы водорода молекул воды, входящих в комплекс, за счет поляризации связей приобретают больший положительный заряд. Водород, ассоциированный с хлором, приобретает заряд +0.48 (был +0.43), а на атоме водорода ассоциированным с молекулой воды в димере заряд изменяется от +0.47 до +0.54. Несколько больше увеличиваются заряды на атомах в комплексе ацетата натрия с двумя молекулами воды: заряд на атоме водорода, ассоциированный с кислородом карбоксилатной группы, увеличился до +0.54 (был +0.43), а атом водорода, участвующий в образовании водородной связи с другой молекулы воды имеет заряд +0.54. Очевидно, что большая поляризация связей димера воды имеет место в комплексах с ацетатом и формиатом натрия.
Выигрыш энергий комплексообразования был оценен по формуле:
ΔEкомпл=∑Eисх - ∑Eкомпл.
И хотя значения энергии отличаются незначительно, по стабильности комплексы можно расположить в ряд:
ΔEHCOONa (-38.4) > ΔECH3COONa (-38.3) > ΔENaCl (-38.1) (ккал/моль)
Причем образование циклического тетрамера воды из двух димеров энергетически менее выгодно (ΔEтетрамер = -26.7 ккал/моль), что указывает на возможность распада кластеров с образованием устойчивых солевых комплексов.
Вычисление барьеров вращения атома водорода связанного с хлором натрхлоридного комлекса вокруг водородной H…O-связи имеет незначительную величину (2.8 ккал/моль). При этом величина барьера вращения почти в 2 раза увеличивается в HO-группе связанной с кислородом ацетатной или формиатной группы. Эти отличия в энергиях барьеров вращения при пониженных температурах играют весьма значительную роль, способствуя более стабильным комплексам встраиваться в кластерную структуру и оказывать влияние на полярность пространственной поликластерной структуры воды.
Этот анализ объясняет существенное влияние значительного количества натркарбоксилатных групп в сополимерах акриламида-акрилата натрия, низкоконцентрированные растворы которых обладают пониженной температурой замерзания и малой условной вязкостью в случае полифторалкилированных производных, что позволяет рекомендовать их для использования в различных областях техники.
Список литературы
- Рахимов А.И., Вострикова О.В. Синтез и свойства полифторалкилхлорсульфитов // Соединения фтора. Химия, технология, применение. Сборник научных трудов (Юбилейный выпуск). 2009. С. 314-321.
- Рахимов А.И., Налесная А.В., Вострикова О.В., Рахимова Н.А., А.С. Бабушкин. Реакции карбоксилсодержащих соединений и их солей с полифторалкилсульфитами // Известия Волгоградского государственного технического университета: межвуз. сб. науч. ст. Серия химия и технология элементорганических мономеров и полимерных материалов. 2009. N 2. С. 30-32.
- Сторожакова Н.А., Рахимов А.И., Налесная А.В. Синтез полифторалкиловых эфиров олигомеров ε-аминокапроновой кислоты // Известия Волгоградского государственного технического университета: межвуз. сб. науч. ст. Серия химия и технология элементорганических мономеров и полимерных материалов. 2007. N 1. С. 39-52.
- Зенин С.В., Тяглов П.В. Гидрофобная модель структуры ассоциатов молекул воды // Журнал физ. химии. 1994. Т. 68. N 4. С. 656.
Материал рекомендован к публикации членом редколлегии А.И. Рахимовым
Fluorine Notes, 2011, 77, 3-4


