Fluorine Notes, 2010, 73, 9-10
Fluorine notes, Номер 6(73) 2010
УДК [547.539.141+547.539.151]:[547.569.1+547.569.2+547.541.514+547.544.31]
РЕАКЦИИ ПОЛИФТОРАРЕНТИОЛОВ С ЭЛЕКТРОФИЛАМИ. СИНТЕЗ И НЕКОТОРЫЕ ПРЕВРАЩЕНИЯ АЛЛИЛПОЛИФТОРАРИЛСУЛЬФИДОВ И -СУЛЬФОНОВ
(устный доклад на VIII Регулярном Российско-Германо-Украинском Симпозиуме по Химии Фтора)
Р.А. Бредихин*, А.М. Максимов, В.Е. Платонов
Учреждение Российской академии наук Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения РАН, г. Новосибирск, Россия
Российская Федерация, Новосибирск, пр. Акад. Лаврентьева, 9; телефон (383)3306943, E-mail: bred@nioch.nsc.ru
Аннотация. Взаимодействием полифторарентиолов с хлористым и бромистым аллилом, хлористым бензилом получены аллил- и бензилполифторарилсульфиды. Из полифторарентиолов в реакциях с тригалогенметанами образуются дигалогенметилполифторарилсульфиды, гидрополифторарены, ортоформиаты в зависимости от природы заместителя полифторарентиола и природы галогена тригалогенметана. Из полифторарентиолов под действием брома и азотной кислоты получены полифтораренсульфонилбромиды. Из полифтораренсульфонилбромидов в реакциях с хлористым аллилом получены продукты присоединения к двойной связи, в то время как с бромистым аллилом – аллилполифторарилсульфоны
Ключевые слова: полифторарентиолы, полифтораренсульфонилбромиды, аллилполифторарилсульфиды, бензилполифторарилсульфиды, аллилполифторарилсульфоны, галоформы, хлористый аллил, бромистый аллил, хлористый бензил, фтордихлорметан, дихлорметан, трихлорметан, трибромметан, Br2, HNO3
Полифторарентиолы известны давно и были предметом изучения в ряде работ. Однако, их химические свойства по-прежнему представляют интерес. Полифторарентиолы получают взаимодействием полифтораренов с гидросульфидом щелочного металла – натрия или калия [1,2]. Нами проводятся работы по реакциям полифторарентиолов с электрофильными реагентами, протекающим с модификацией тиольной группы без изменения ароматического фрагмента.
Ранее для получения аллилпентафторфенилсульфида были предложены несколько подходов [3,4,5]. Один из них заключается во взаимодействии пентафторбензолтиола с бромистым аллилом в двухфазной системе бензол-вода в присутствии гидроксида натрия и катализатора межфазного переноса [3]. Другие подходы для получения этого соединения включают использование металлорганических реагентов [4, 5].
Нами найдено, что аллилполифторарилсульфиды получаются в реакции полифторарентиолов с хлористым или бромистым аллилами с хорошими выходами в присутствии карбоната калия в растворителе при комнатной температуре. Если реакцию проводят в ДМФА, целевой сульфид может быть легко выделен из реакционной массы перегонкой с водяным паром.
В подобных условиях полифторарентиолы реагируют с хлористым бензилом, что приводит к соответствующим бензилполифторарилсульфидам с высокими выходами (Схема 1). Целевые сульфиды могут быть выделены в виде белого осадка при разбавлении реакционной массы водой.
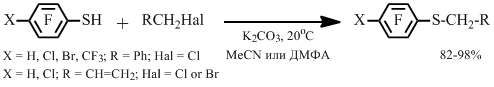
Схема 1
Замещение двух геминально-расположенных атомов хлора на фрагмент арентиола также возможно, что показано на примере реакции 2,3,5,6-тетрафторбензолтиола 1 с дихлорметаном (Схема 2).
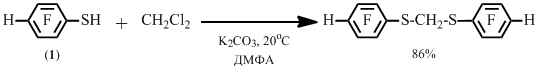
Схема 2
Предметом нашего исследования также являлись реакции полифторарентиолов с тригалогенметанами. Известно, что при взаимодействии полифтоарентиолов с дифторхлорметаном в присутствии гидроксида натрия получаются соответствующие дифторметилполифторарилсульфиды с высокими выходами [6].
В то же время нами показано, что реакция полифторарентиолов с фтордихлорметаном приводит к образованию смеси фторхлорметилполифторарилсульфида и гидропроизводного полифторарена, которое может преобладать.
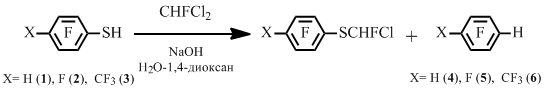
Схема 3
Оказалось, что в реакции тиола 3 с трихлор- или трибромметаном основным продуктом является гептафтортолуол 6. В то же время, реакция бензолтиола 1 с трихлор- или трибромметаном приводит, в основном, к трис(тетрафторфенилтио)ортоформиату 7. При этом также наблюдается образование тетрафторбензола 4 (Схема 4). Ранее образование подобного ортоформиата наблюдали в реакции пентафторбензолтиола с трииодметаном наряду с продуктами самоконденсации пентафторбензолтиола [7].
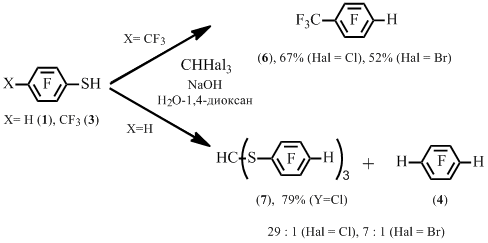
Схема 4
Реакции 6-хлор-4-трифторметил-2,3,5-трифторбензолтиола 8 с трихлорметаном получено гидропроизводное 9 (Схема 5), которое ранее не удалось получить десульфуризацией арентиола 8 под действием никеля Ренея. В этом случае на атом водорода замещалась как тиольная группа, так и соседний с ней атом хлора.
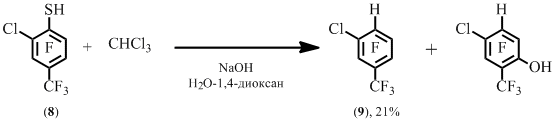
Схема 5
Таким образом, реакции полифторарентиолов с галоидалканами в присутствии основания приводят к различным продуктам реакции в зависимости от структуры полифторарентиола и структуры галоидалкана.
Нами также изучены некоторые превращений полифторарентиолов под действием электрофильных реагентов, обладающих окислительным действием и содержащих источники брома.
Известно, что нефторированные арентиолы превращаются в аренсульфонилбромиды под действием брома в уксусной кислоте [8]. В тоже время, реакция 4-хлор-2,3,5,6-тетрафторбензолтиола с бромом приводила только к соответствующему диарилдисульфиду [9].
Ранее был описан синтез пентафторбензолсульфонилбромида из хлорпентафторбензола через реактив Гриньяра. При этом в значительном количестве получался побочный продукт – бис(пентафторфенил)сульфон [10].
Недавно нами был предложен метод получения полифтораренсульфонилбромидов, основанный на реакции полифторарентиолов с различными источниками брома [11]. Наибольшего выхода целевого продукта удавалось достичь при использовании смеси брома и дымящей азотной кислоты, смеси брома и концентрированных азотной и серной кислот или смеси концентрированных азотной, серной и бромоводородной кислот (Схема 6).
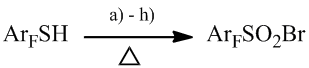
a). Br2 + дымящая HNO 3 ; b). Br2 + HNO3 + H2SO4; c). HBr + HNO3 + H2SO4; выходы 70-90%;
d). NaBr + HNO3; e). Br2 + HNO3; выходы 45-60%;
f). Br2 + H2SO4; g). Br2 + CH3COOH; h). Br2 + H2O;
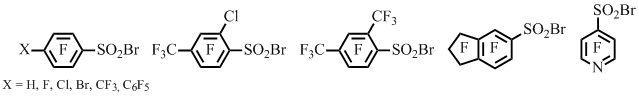
Схема 6
В то же время реакция пентафторбензолтиола с бромом в среде серной или уксусной кислот или в воде приводила к смеси пентафторбензолсульфонилбромида 10 и декафтордифенилдисульфида 11 в различных соотношениях.
При снижении температуры реакции пентафторбензолтиола 2 со смесью концентрированных азотной, серной и бромоводородной кислот также получается смесь дисульфида 11 и сульфонилбромида 10. Отдельно было показано, что дисульфид 11 также может быть превращен в сульфонилбромид 10 в условиях получения сульфонилбромида 10 из бензолтиола 2(Схема 7).
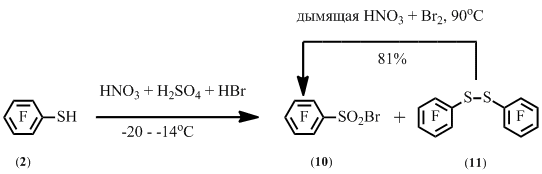
Схема 7
Полученные полифтораренсульфонилбромиды представляют интерес как источники полифтораренсульфонильных радикалов [10]. Известно радикальное присоединение нефторированных аренсульфонилбромидов к двойной, тройной связи, а также 1,4-присоединение к сопряжённой системе диенов [12, 13, 14]. В этих реакциях образуются продукты, содержащие как аренсульфонильную группу, так и атом брома.
Нами найдено, что полифтораренсульфонилбромиды присоединяются к двойной связи хлористого аллила при нагревании или при комнатной температуре при освещении рассеянным дневным светом.
В то же время оказалось, что реакция полифтораренсульфонилбромидов с бромистым аллилом приводит к аллилполифторарилсульфонам. При этом также образуется 1,2,3-трибромпропан (18) (Схема 8).
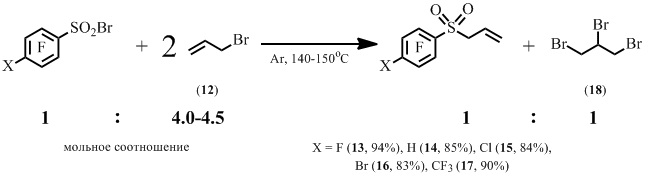
Схема 8
Было показано, что данное превращение происходит уже при комнатной температуре.
Возможная схема процесса включает образование
полифтораренсульфонильного радикала, его присоединение к двойной связи
бромистого аллила и элиминирование атома брома (Схема 9).
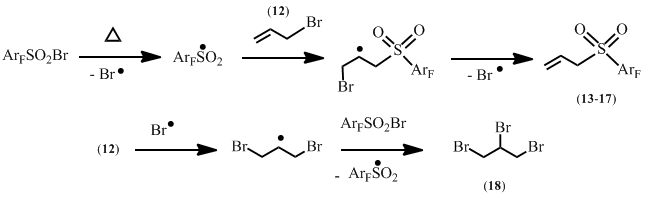
Схема 9
Реакция замедляется в присутствии гидрохинона и ускоряется при освещении рассеянным дневным светом или при добавлении иодида меди (I), что подтверждает радикальный характер процесса.
Недавно было показано, что индий является катализатором реакции бензолсульфонилхлорида с аллилом (12), приводящей к образованию аллилфенилсульфона [15]. Нами найдено, что взаимодействие сульфонилбромида (10) с аллилом (12) в присутствии цинковой пыли в 1,4-диоксане в течение 3 ч при комнатной температуре приводило аллилпентафторфенилсульфону (13) с хорошим выходом. При этом количество образующегося трибромпропана (18) значительно снижалось.
Возможная схема процесса может включать одноэлектронный перенос с образованием анион-радикала полифтораренсульфонилбромида и его фрагментацию с образованием бромид-аниона и полифтораренсульфонильного радикала.
Нагревание сульфонилбромида (10) и аллилсульфона (17) приводит к образованию сульфонилбромида (20) и аллилсульфона (13). В то же время, нагревание сульфонилбромида (20) и аллилсульфона (13) приводит к образованию сульфонилбромида (10) и аллилсульфона (17) (Схема 10).
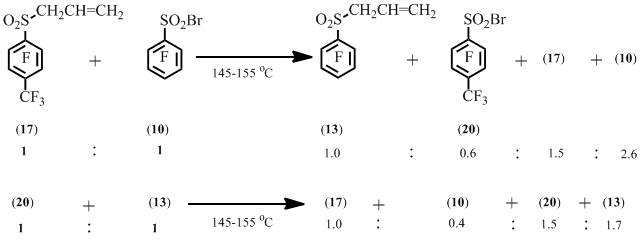
Схема 10
Этот результат может свидетельствовать об обратимости образования аллилсульфона в реакции полифтораренсульфонилбромидов с аллилполифторарилсульфонами.
Список литературы
- Robson P., Stacey M., Stephens R., Tatlow J.C. Aromatic Polyfluoro-compounds. Part VI . Penta- and 2,3,5,6-Tetra-fluorothiophenol // J. Chem. Soc. 1960. N 12. P. 4754-4760.
- Maksimov A.M., Platonov V.E., Reactions of some polyfluoroaromatic compounds with potassium hydrosulfide // Fluorine notes: сетевой журн. 1999, N 4(5), URL: /contents/history/1999/4_1999/letters/index.html (дата обращения: 26.11.2010).
- Baechler, R.D., Filippo, L.J.S., Schroll, A.Structural effects upon competitive decomposition pathways of thiosulfoxide intermediates // Tetrahedron Lett. 1981. V. 22. N 52. P. 5247-5250.
- W.E. Ward, S. Sicree, B.Chen, C. Tamborski. Synthesis of polyfluoroarylalkyl sulfide compounds// J. Fluorine Chem. 1995. V. 73. N 1. P. 73-77.
- G.M. Brooke, D.I. Wallis. Partially Fluorinated Heterocyclic Compounds. Part 14. Syntheses of 4,5,6,7-Tetrafluoro-2,3-dihydro-2-methyl-1-benzothiophen and 5,6,7,8-Tetrafluorothiochroman from Pentafluorophenyl Prop-2-enyl Sulphide via the Claisen Rearrangement Intermediate and the Related Reaction of Prop-2-enyl-2,3,5,6-Tetrafluorophenyl Sulphide. Reactions which appear to proceed via Homolytic Fission of an Aliphatic Carbon-Fluorine Bond // J.Chem.Soc., Perkin Trans. 1.1981. N 6. P. 1659-1664.
- Maksimov A.M., Kireenkov V.V., Platonov V.E. Organofluorine sulfur-containing compounds 3. Preparation of difluoromethylpolyfluoroaryl sulfides. Reactions of difluoromethylpentafluorophenyl sulfide with oxidants // Rus. Chem. Bull. 1996. V. 45. N 1. P. 153-155.
- Wragg R.T. Alkylation reactions of pentafluorothiophenol in dimethylformamide // Tetrahedron Lett. 1971. V. 12. N 27. P. 2475-2473.
- Zincke Th., Frohenberg W. Über p-Thiokresol // Ber. 1910.V. 43. N 1. P. 837-848.
- Фурин Г.Г., Щёголева Л.И., Якобсон Г.Г. Ароматические фторпроизводные LXVII. Взаимодействие полифторированных диарилдисульфидов с неполностью фторированными ароматическими соединениями в присутствии пятифтористой сурьмы // Журн. орган. химии. 1975. Т. 11. Вып. 6. С. 1290-1297.
- Chen Q.Y., Chen M.F. Pentafluorobenzenesulfonyl bromide and its reactions // Chinese Chemical Letters. 1991. V. 2. N 8. P. 597-600.
- Platonov V.E., Bredikhin R.A., Maksimov A.M., Kirienkov V.V. A novel and efficient method for the synthesis of polyfluoroarenesulfonyl bromides from polyfluoroarenethiols // J. Fluorine Chem. 2010. V. 131. N 1. P. 13-16.
- Riggi I.De., Surzur J.-M., Bertrand M.P. Addition radicalaire d`halogenures de sulfonyle cyclization et bifonctionalisation du cyclooctadiene-1,5 et de dienes-1,6 // Tetrahedron. 1988. V. 44. N 23.P. 7119-7125.
- Pelter A., Ward R.S., Little G.M. Approaches to 2,6-Diaryl-3,7-Dioxabicyclo[3,3,0]Octane Lignans via Asymmetric Synthesis of Dihydro- and Tetrahydro-furan Derivatives // J. Chem. Soc. PerkinTrans.1. 1990. N 10. P. 2775-2790.
- Танасков М.М., Стадничук, М.Д. Взаимодействие трет.-бутилбутадиена и его кремний- и германийсодержащих аналогов с галогенангидридами сульфоновых кислот // Журн. общей химии. 1977. Т. 47. N 8. С. 1813-1822.
- Wang L., Zhang Y. Indium-mediated Coupling Reaction of Sulfonyl Chloride with Alkyl Bromides in Water. A Facile Synthesis of Sulfones // J. Chem. Res. (S). 1998. V. 9. P. 588-589.
Fluorine notes, Номер 6(73) 2010
Fluorine Notes, 2010, 73, 9-10


