Fluorine Notes, 2010, 73, 3-4
Fluorine notes, Vol. 6(73) 2010
УДК 547-39
Синтез перфтордиацилперекисей и кинетика их термического разложения
О.С. Базанова, Л.Ф. Соколов, Б.Н. Максимов
Федеральное государственное унитарное предприятие "Российский научный центр "Прикладная химия", 197198, Санкт-Петербург, пр. Добролюбова 14, тел. (812)7030639, e-mail: Bmaximov@rscac.spb.ru
Аннотация. Изучены синтез и кинетика термического разложения ряда перфторированных диацилпероксидов, используемых в качестве инициаторов сополимеризации тетрафторэтилена с перфтор(-3,6-диокса-4-метил-7-октен)сульфонилфторидом.
Ключевые слова: Диацилпероксиды, тетрафторэтилен, сополимеризация
В литературе имеется ряд сообщений о синтезе перфтордиацилперекисей (ПФДАП) и об их использовании в качестве инициаторов полимеризации фторуглеродных α-олефинов [1-5]. Известно, что ПФДАП способны инициировать полимеризацию при относительно низких температурах (~ 20-50оС), однако кинетика термического разложения ПФДАП изучена мало.
В настоящей работе изучен синтез и термический распад ряда доступных ПФДАП.
Синтез перфтордиацилперекисей
В качестве исходных соединений для синтеза ПФДАП использован ряд фторангидридов: перфторциклогексаноилфторид, димеры и тримеры гексафторпропиленоксидов, а также фторангидриды, полученные в качестве побочных соединений при синтезе перфтор(-3,6-диокса-4-метил-7-октен)сульфонилфторида – мономера ФС-141:
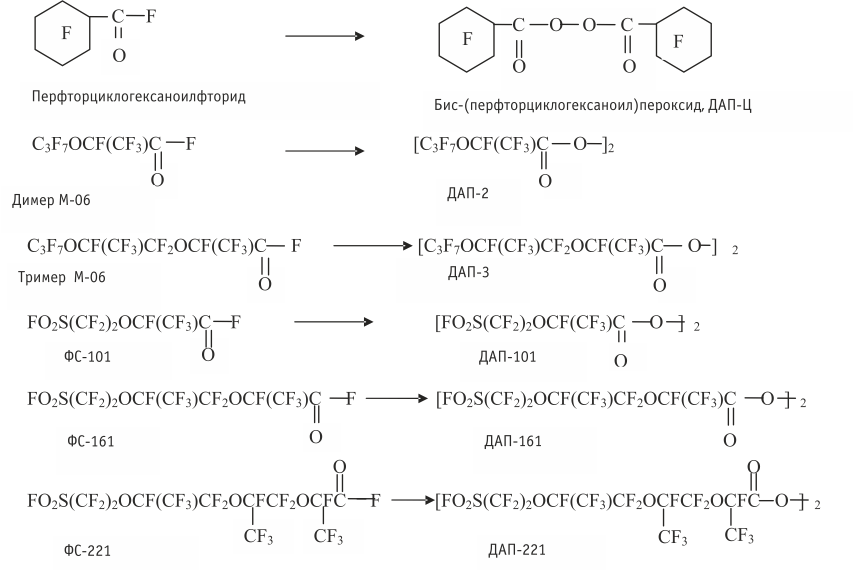
Результаты представлены в табл. 1.
Табл. 1. Условия синтеза диацилперекисей
Синтезируемая перекись |
ДАП-Ц |
ДАП-2 |
ДАП-3 |
ДАП-101 |
ДАП-161 |
ДАП-221 |
||||||
Растворитель |
R-113 |
FC-75 |
R-113 |
FC-75 |
R-113 |
FC-75 |
R-113 |
FC-75 |
R-113 |
FC-75 |
R-113 |
FC-75 |
Концентрация перекиси г/мл |
0,062 |
0,068 |
0,045 |
0,047 |
0,040 |
0,038 |
0,009 |
0,007 |
0,015 |
0,010 |
0,021 |
0,012 |
Выход, % масс. |
78 |
86 |
56 |
59 |
47 |
45 |
30 |
25 |
38 |
26 |
72 |
39 |
В качестве растворителя использовались 1,1,2-трифтор-2,2,1-трихлорэтан (R-113) и перфтор(-2-бутилтетрагидрофуран) (FC-75).
На примере ДАП-Ц изучено влияние некоторых факторов, а именно температуры, скорости перемешивания и различных растворителей на выход продукта (табл. 2).
Табл.2. Влияние условий синтеза на выход ПФДАП
Температура,oС |
Скорость перемешивания n, об/мин |
Тип растворителя |
|||||||||||
-10 |
0 |
10 |
18 |
100 |
300 |
500 |
760 |
R-113 |
FC-75 |
МД-46 |
RС-316 |
СНCl3 |
|
Концентрация, г/мл |
0,062 |
0,048 |
0,036 |
0,027 |
0,042 |
0,049 |
0,054 |
0,06 |
0,062 |
0,068 |
0,038 |
0,04 |
0,022 |
Выход, % |
78 |
60 |
45 |
34 |
53 |
62 |
68 |
75 |
78 |
86 |
48 |
52 |
28 |
В качестве растворителей применяли:
1,1,2-трифтор-2,2,1-трихлорэтан – R-113;
перфтор(-2-бутилтетрагидрофуран) – FC-75; перфторметилдиэтиламин –
МД-46; гексафтордихлорциклобутан – RС-316; хлороформ – СНCl3.
Влияние температуры синтеза: при повышении температуры от -10; до 18oС (см. таблицу 2) выход продукта снижается. По-видимому с увеличением температуры синтеза, растет число побочных реакций и увеличивается выход побочных продуктов.
Влияние скорости перемешивания: с увеличением скорости перемешивания от 100 до 760 об/мин (см. табл. 2) выход перекиси растет. Это объясняется тем, что интенсивное перемешивание улучшает контакт реагентов, находящихсмя в разных слоях ( водном и органическом) реакционной массы.
Влияние растворителей: из данных табл.2 можно сделать вывод, что различные растворители оказывают разное воздействие на выход перекиси. Это можно связать с различной полярностью растворителей. Чем выше полярность растворителя, тем больше выход продукта, так как сила электростатического взаимодействия частиц растворителя с молекулами растворенного вещества растет и тем самым ускоряет реакцию и увеличивает выход конечного продукта.
Разложение перфтордиацилперекисей
Термическое разложение перекисей проводилось в среде хладона R-113 в плотно закрытой стеклянной пробирке, помещенной в ультратермостат. Температуру поддерживали с точностью до ± 0,1oС. Через равные промежутки времени определялась концентрация перекиси йодометрическим титрованием, в результате чего строился график зависимости концентрации перекиси от времени разложения, и определялось время полураспада перекиси. Данные представлены в табл.3.
Табл. 3. Термораспад ПФДАП
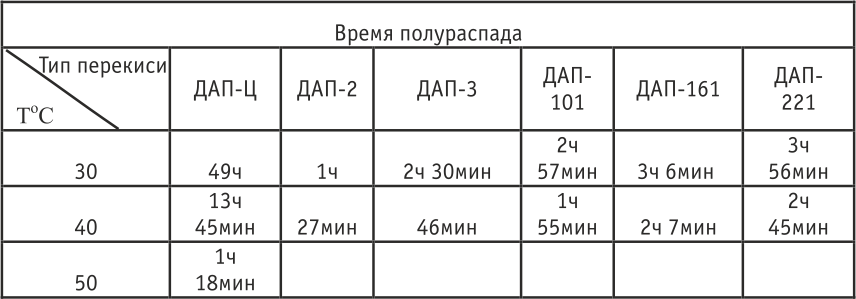
Результаты, приведенные в табл.3, свидетельствуют, что скорость термического распада ПФДАП сильно зависит от структуры ацильных групп, что позволяет выбирать оптимальный тип ПФДАП в зависимости от планируемой температуры процесса полимеризации.
Термическое разложение ПФДАП - сложный процесс, включающий как гомолиз по одной или нескольким связям, так и нерадикальный мономолекулярный распад через циклическое переходное состояние, причем кинетически оба направления трудноразделимы. Изучение механизма имеет большое прикладное значение для усовершенствования традиционных процессов полимеризации ненасыщенных соединений [7], где в качестве инициаторов широко используются ПФДАП. Результаты кинетической обработки экспериментальных данных термического разложения ПФДАП приведены в табл. 4:
Табл. 4 Термическое разложение ПФДАП (растворитель R-113)
Перекись |
Интервал температур, oС |
Константа скорости разложения, сек-1 |
ДАП-Ц |
40-60 |
7,9*1018ехр(-22200/RT) |
ДАП-2 |
30-50 |
3,8*1014ехр(-23100/RT) |
ДАП-3 |
30-50 |
2,9*1014ехр(-22700/RT) |
ДАП-101 |
30-50 |
2,5*1014ехр(-21800/RT) |
ДАП-161 |
30-50 |
2,6*1012ехр(-25000/RT) |
ДАП-221 |
30-50 |
1,9*1010ехр(-26200/RT) |
Данные, приведенные в таблице 4, свидетельствуют, что термическое разложение ПФДАП в сравнении с нефторированными аналогами характеризуется существенно меньшими значениями энергии активации, при этом увеличение длины перфторированного радикала в ПФДАП вызывает некоторое снижение энергии активации термического разложения.
Экспериментальная часть
Синтез ПФДАП основан на реакции взаимодействия
галоидангидридов перфторированных карбоновых кислот с водным раствором
перекиси натрия, образующемся при взаимодействии гидроксида натрия и
перекиси водорода.
Синтез проводят в стеклянной круглодонной колбе объемом 500 мл с
мешалкой , капельной воронкой и термометром , помещенной в баню с
температурой минус 10 – минус 15oС (смесь льда и хлористого натрия). При температуре в бане минус 15oС
и работающей мешалке (n = 300 об/мин) в колбу через воронку
загружают: хладон R113, насыщенный водный раствор NaCl, 30%-ный водный
раствор NaOH и 30%-ный раствор Н2О2.
Выдерживают содержимое колбы до установления температуры реакционной смеси минус 8 – минус 10oС и постепенно, по каплям при работающей мешалке вводят в колбу из капельной воронки фторангидрид перфторкарбоновой кислоты с такой скоростью, чтобы температура реакционной смеси не превышала минус 7oС.
После введения всего количества фторангидрида реакционную массу в колбе выдерживают при перемешивании 30 минут при температуре минус 7 – минус 10oС . Затем для нейтрализации реакционной массы в колбу из капельной воронки вводят насыщенный водный раствор NaHCO3, охлажденный до минус 8oС и выдерживают 15 минут при перемешивании.
Содержимое колбы переводят в делительную воронку, отстаивают 5 минут, отделяют нижний фторуглеродный слой, содержащий растворенный перфтордиацилпероксид, трижды промывают его в делительной воронке охлажденным до минус 10°С насыщенным раствором NaCl, фторуглеродный слой отделяют, помещают в полиэтиленовую банку, герметично закрывают и хранят в морозильной камере холодильника при температуре -10оС и ниже.
Концентрацию перекиси в растворителе определяют йодометрическим титрованием по методике с применением уксусной кислоты и хлороформа [6]. Смешанный растворитель применяется для повышения растворяющей способности уксусной кислоты. В колбу для определения помещают навеску, содержащую 0,1 г-экв перекиси, добавляют 20 мл растворителя (смесь уксусной кислоты и хлороформа 3:2) и содержимое колбы продувают инертным газом. После добавления 1 мл насыщенного свежеприготовленного раствора иодида натрия колбу помещают в затемненное место, затем содержимое колбы титруют 0,1н раствором тиосульфата натрия до исчезновения желтой окраски. Заниженные результаты получаются, когда растворитель содержит больше хлороформа, чем уксусной кислоты, так как необходим ионизирующий растворитель, а количество хлороформа должно быть не больше, чем это необходимо для растворения пробы.
Расчет концентрации перфтордиацилпероксида производят по формуле:
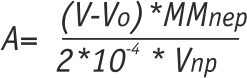
где V - количество тиосульфата натрия, пошедшее на титрование, мл
Vо - количество тиосуфата натрия в холостом опыте, мл
ММпер - молекулярная масса синтезируемой перекиси, г/моль
Vпр - объем пробы, мл.
Заключение
Таким образом результатом исследования явилась разработка метода получения перфтордиацилперекисей для процессов полимеризации фтормономеров на основе доступных исходных фторангидридов перфторкислот различной структуры.
Работа проводилась по государственному контракту № 02.513.12.3070 при финансовой поддержке Федерального агентства по науке и инновациям.
Список литературы
- Патент США 2559630, 1951
- Патент США 2580358, 1951
- Патент США 3642742, 1972
- Патент США 3674758, 1972
- D.E. Ryce, C.L. Sondberg, Polymer Preprints, 12, 276, 1971
- В.Л. Антоновский, М.М. Бузланова "Химические и хроматографические методы анализа органических перекисей" Обзоры по отдельным производствам химической промышленности", НИИТЭХИМ, М., 1972, вып. 46, с.5.
- Marco R., Shreeve J.M. – Adv. Inorg. Chem. A Rad., 1974. N 16, р.110-169.
Fluorine Notes, 2010, 73, 3-4


